|
Chimie : chlore, dichlore, chlorure, précipitation, conductimétrie concours Mines 2009.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le chlore a pour numéro atomique Z = 17. Masse atomique molaire de H : 1 g.mol-1 Masse atomique molaire de Cl : 35,5 g.mol-1 (g), (l), (s), (aq) après la formule d’une espèce chimique signifient respectivement gazeux, liquide, solide et aqueux. Généralités. Que représente le numéro atomique d’un élément chimique ? Le numéro atomique représente le nombre de protons du noyau de l'atome, le nombre d'électron de l'atome. C'est encore le nombre de charges. Quelle est la configuration électronique du chlore dans son état fondamental ? 1s2 2s2 2p6 3s2 3p5. Dans quelle colonne de la classification périodique se situe le chlore ? Comment se nomment les éléments de cette colonne ? Le chlore appartient à la famille des halogènes, colonne 17 ( VII A) Faire les schémas des structures de Lewis les plus probables des molécules de dichlore et de chlorure d’hydrogène (HCl). Donner dans les deux cas les nombres d’oxydation du chlore.  Dans HCl, le nombre d'oxydation du chlore vaut -1 et dans Cl2, le nombre d'oxydation du chlore est nul. Qu’est ce qu’un nucléon ? Un nucléon est un constituant du noyau de l'atome, c'est à dire un proton ou un neutron. Rappeler la définition de deux isotopes d’un même élément. Deux isotopes possèdent le même nombre de protons ( même numéro atomique) mais des nombres de neutrons différents. Le chlore a une masse atomique molaire moyenne d’environ 35,5 g.mol-1. Il est essentiellement composé des isotopes 35 et 37. La masse molaire d’un nucléon est prise à 1 g.mol-1.
Sous la pression P0 = 1 bar maintenue constante, à la température T, à partir d’un mélange de HCl(g) et de O2(g), il se forme Cl2(g) et H2O(g). Ecrire l’équation bilan de la réaction avec 1 pour coefficient (nombre) stoechiométrique de O2. 4HCl(g) +O2(g) = 2Cl2(g) +2H2O(g). Les réactifs sont pris en quantités stoechiométriques (1 mole de O2). Quel est l’avancement maximum xmax de cette réaction ? Dans le cas d'une réaction totale, les deux réactifs disparaissent en fin de réaction : xmax = 1 mol. A l’équilibre, 75% de HCl a disparu. Déterminer l’avancement xe de la réaction à l’équilibre.
Par suite : 4-4xe =1 soit xe =0,75 mol. Les gaz étant supposés parfaits, déterminer les pressions partielles de chacun des constituants à l’équilibre. Nombre total de moles à l'équilibre : N = 4,25 moles. Fractions molaires : XHCl =1/4,25 =0,235 ; XO2 =0,25/4,25 =0,059 ; XCl2 =XH2O =1,5/4,25 =0,353. Pressions partielles : PHCl =XHCl P0 =0,235 bar ; PO2 =XO2 P0 = 0,059 bar ; PCl2 =PH2O =XCl2 P0=0,353 bar. Exprimer la constante de cet équilibre K0P à la température T en fonction des pressions partielles et la calculer. K0P=P2Cl2 .P2H2O / ( PO2.P4HCl) = 0,3534 / (0,059 *0,2354) =86,3 ~ 86.
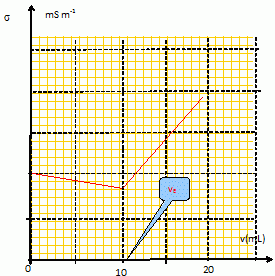
Dosage des ions chlorure Cl-(aq) par précipitation. Dans cet exercice, tous les ions sont sous forme aqueuse. Pour s’assurer que le dosage des ions Cl-(aq) par les ions Ag+(aq) est possible, on réalise au préalable la manipulation suivante. On effectue le dosage de V1 = 100 mL d’une solution S1 placée dans le bécher, de chlorure de sodium (Na+, Cl-) de concentration C1 = 10-2 mol.L-1 par une solution S2 de nitrate d’argent (Ag+, NO3-) placée dans la burette, de concentration C2 = 8.10-2 mol.L-1. Le produit de solubilité du chlorure d’argent AgCl(s) est : K0S1 =10-10. Ecrire la réaction de dosage. Ag+(aq) + Cl-(aq) = AgCl(s). Exprimer la constante d’équilibre K en fonction des concentrations. K = 1/ ([Ag+(aq)][Cl-(aq)]) =1/ K0S1 = 1010. La précipitation débute-t-elle dès la première goutte ? (une goutte = 0.05 mL). La précipitation débute dès que le produit de solubilité est atteint : [Cl-(aq)]i =C1 = 10-2 mol.L-1. Juste après l'ajout de la première goutte : [Ag+(aq)]i = (8 10-2 *0,05 / 100) = 4 10-5 mol/L. [Cl-(aq)]i [Ag+(aq)]i = 4 10-7 , valeur supérieure au produit de solubilité : la précipitation a débuté. Calculer le volume V2e de la solution de nitrate d’argent versé à l’équivalence. C2V2e =V1 C1 ; V2e =V1 C1/C2 =100*10-2 /8.10-2= 12,5 mL ~ 13 mL. On a ajouté dans le bécher, en guise d’indicateur coloré, V3 = 2 mL d’une solution de chromate de potassium K2CrO4, (2 K+, CrO42-) de concentration C3 = 1 mol.L-1, susceptible de donner le précipité Ag2CrO4(s), de couleur rouge, dont le produit de solubilité est K0S2 =10-11,8. Ecrire la réaction de précipitation de Ag2CrO4(s). Ag2CrO4(s) = 2Ag+ aq+ Cr042- aq ; Exprimer la constante d’équilibre K0S2 en fonction des concentrations. K0S2 = [ Ag+ aq]2[ Cr042- aq] Montrer que AgCl(s) précipite avant Ag2CrO4(s). AgCl(s) = Ag+ aq+ Cl- aq; K0s1 = [ Ag+ aq][ Cl- aq] avec [ Cl- aq]initial = 10-2 mol/L. AgCl commence à précipiter dès que [ Ag+ aq] = K0s1 / [ Cl- aq]initial = 10-10 / 10-2 = 10-8 mol/L Ag2CrO4(s) = 2Ag+ aq+ Cr042- aq ; K0S2 = [ Ag+ aq]2[ Cr042- aq] avec [ Cr042- aq]initial =C3V3/ (V3+V1)=2/102= 1,96 10-2 mol/L Ag2CrO4 commence à précipiter dès que [ Ag+ aq] =[ K0S2 / [ Cr042- ]initial ]½=[ 10-11,8 / 1,96 10-2 ]½ = 9 10-6 mol/L AgCl précipite donc en
premier. [ Cr042- aq]éq =C3V3/ (V3+V1+V2e)=2/114,5= 1,74 10-2 mol/L. Ag2CrO4 commence à précipiter dès que [ Ag+ aq] =[ K0S2 / [ Cr042- ]initial ]½=[ 10-11,8 / 1,74 10-2 ]½ = 9,5 10-6 mol/L. [ Cl- aq] =K0s1 / [ Ag+ aq] = 10-10 / 9,5 10-6 =1,0 10-5 mol/L.
Cinétique. La
cinétique de cette réaction étant d’ordre 1 par rapport à RCl, exprimer
la loi de vitesse, en déduire une équation différentielle en x,
l’intégrer et exprimer la concentration x en fonction de a, de t et de
la constante de vitesse k.
[ROH]= x = i n/ V0 ; [RCl]= (aV0 - i n)/ V0 =a-x
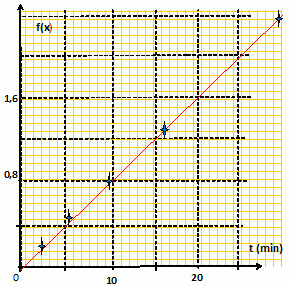
v =k[RCl] = -d[RCl]/dt avec [RCl] = a-x et [ROH]=x ; -d[RCl]/dt = dx/dt Quelle fonction f(x) doit-on tracer pour différentes valeurs de t si l’on veut obtenir une droite de pente +k ? Le tableau ci-dessous donne les différentes valeurs des ti. Reproduire et compléter ce tableau.
Placer les couples de points (f(xi), ti
) sur un graphe (tracé sur la feuille). Leur alignement est-il
satisfaisant ? Déduire la valeur de la constante de vitesse k en
précisant bien son unité. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|