|
Synthèse d'un étheroxyde : catalyse par transfert de phase concours Mines 2009. |
||||||||||||||||||
| .
. |
||||||||||||||||||
|
||||||||||||||||||
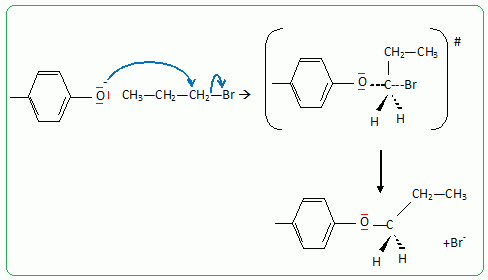
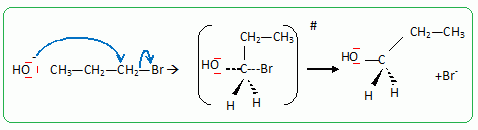
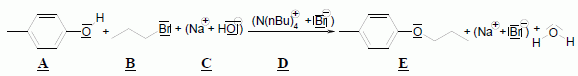 Pour réaliser la synthèse de l’étheroxyde E, on introduit dans un ballon : • 8,00 g de 4-méthylphénol A (soit 7,41.10-2 mol) ; • 9,10 g de 1-bromopropane B (soit 7,40.10-2 mol) ; • 3,00 g d’hydroxyde de sodium C (soit 7,50.10-2 mol) dans 10,0 mL d’eau ; • 0,20 g de bromure de tétrabutylammonium (N(C4H9)4+ + Br-) D (soit 6,2.10-4 mol) dont le rôle sera expliqué dans la partie suivante. On réalise alors un montage à reflux et on agite vigoureusement le milieu réactionnel, constitué de deux phases : une phase organique (qui contient A, B et E) et une phase aqueuse (qui est constituée de la solution d’hydroxyde de sodium C). Préciser l’intérêt du montage à reflux. Le montage à reflux permet d'accélérer la réaction en travaillant à température modérée, tout en évitant les pertes de matière : les vapeurs se condensent dans le réfrigérant à eau et retombent dans le milieu réactionnel. Alors que le pKa d’un couple alcool/alcoolate est couramment compris entre 16 et 18, celui d’un couple phénol/phénolate est situé entre 8 et 10. Le composé A peut donc être déprotoné par la solution d’hydroxyde de sodium. Proposer une justification à cette différence de pKa. L'ion phénolate est stabilisé par résonance : sa charge est délocalisée sur le cycle benzénique. Il n'en est pas de même pour l'ion alcoolate. Le proton du groupe phénol est donc plus acide que le proton d'une fonction alcool. Indiquer une méthode qui aurait permis de déprotoner un alcool comme l’éthanol. Léthanol peut être déprotoné par une base forte comme l'hydrure de sodium NaH. Nommer cette réaction de synthèse d’étheroxyde puis proposer un schéma réactionnel expliquant la formation de E. C'est une synthèse d’éther selon la méthode de Williamson. Le phénolate réagit avec le bromopropane par une réaction de substitution nucléophile de type SN2.
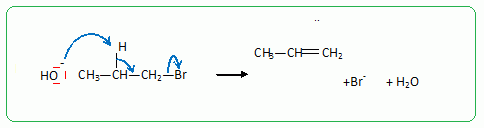
Passage au propan-1-ol par une réaction de substitution nucléophile de type SN2.
Dans une ampoule à décanter on sépare les espèces solubles dans la phase aqueuse et les espèces solubles dans le diethyléther ( le diéthylether et l'eau n'étant pas miscibles ). Le lavage à l'hydroxyde de sodium élimine les traces de A et B en donnant l'étheroxyde E.
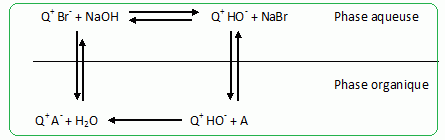
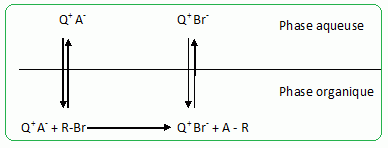
Principe de la catalyse par transfert de phase. On cherche à expliquer le rôle de catalyseur par transfert de phase joué par le bromure de tétrabutylammonium dans la synthèse de l’étheroxyde E. Pour cela, on analyse le mode opératoire suivant : Dans un tube à essai, on obtient une solution violette après avoir introduit quelques cristaux de permanganate de potassium KMnO4 et 1 mL d'eau. On ajoute alors 1 mL de dichlorométhane CH2Cl2 ; après agitation, la phase organique est incolore. On ajoute alors quelques cristaux de bromure de tétrabutylammonium (espèce incolore dans l’eau et le dichlorométhane). Après agitation, la phase organique devient colorée. 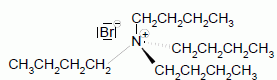 Déterminer les configurations électroniques fondamentales de l’oxygène (Z=8) et du manganèse (Z = 25). Indiquer pour chacun de ces deux éléments le nombre d’électrons de valence. Atome d'oxygène : 1s2 2s2 2p4 ( 6 électrons de valence). Atome de manganèse : 1s2 2s2 2p6 3s2 3p6 4s2 3d5 (2+5 = 7 électrons de valence). En déduire une formule de Lewis représentative de l’ion permanganate MnO4-, et prévoir sa géométrie à l’aide de la méthode VSEPR. On précisera en particulier la valeur de l’angle entre deux liaisons Manganèse-Oxygène. 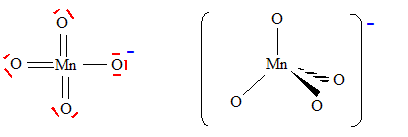 Tétraèdre régulier ( les anglex valent 109° ) ; type AX4. Proposer les formules mésomères les plus représentatives de l’ion permanganate. Que peut-on dire des longueurs des liaisons Manganèse-Oxygène ? 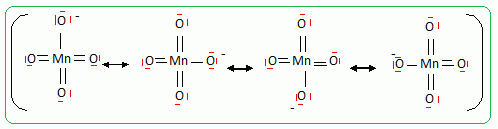 Les liaisons ont des longueurs intermédiaires entre celles des liaisons simples et celles des liaisons doubles.
|
||||||||||||||||||
| |
||||||||||||||||||
|
|