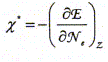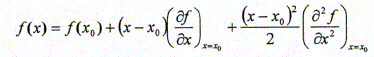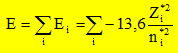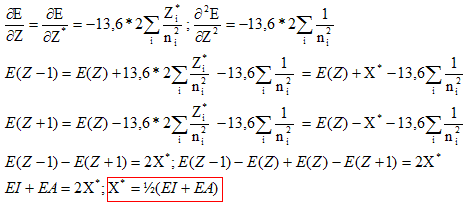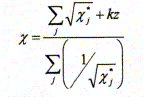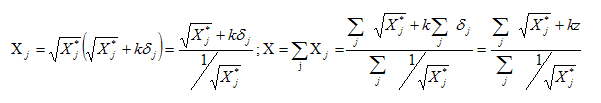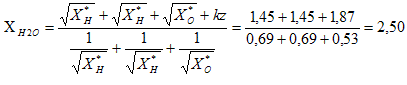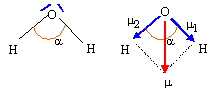|
Synthèse
du dihydrogène ; la molécule d'eau :
électronégativité, moment
dipolaire concours
ingénieur Minefe 2008. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
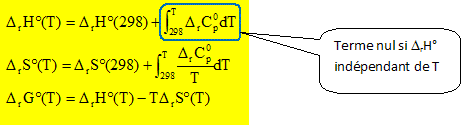
Les citer et donner leur composition. hydrogène 11H ( 1 proton, zéro neutron) ; deutérium 21H ( 1 proton, 1 neutron) ; tritium 31H ( 1 proton, 2 neutrons). Il existe plusieurs voies de préparation du dihydrogène. Proposer trois voies de synthèse. - Reformage du gaz naturel ( CH4 + H2O) vers 900 °C sous 10 bars, en présence de catalyseur au nickel. - Electrolyse d'une solution aqueuse alcaline ( obtention de H2 de grande pureté). - Craquage du méthanol. Soit la synthèse suivante : CH4(g) + H2O(g) = CO(g) + 3H2(g). Cette réaction se fait sous pression totale constante Ptot = 10 bar. La température du réacteur est constante et à cette température, la constante d'équilibre thermodynamique K° est égale à 15. L'enthalpie standard de réaction est considérée comme indépendante de la température DrH° = 206 kJ / mol. Quelle est l'approximation faite sur la capacité calorifique de réaction à pression constante ? Quelle est la conséquence sur l'entropie molaire standard de réaction ? Sur l'enthalpie libre standard de réaction ? DrCp varie très peu avec la pression si celle-ci est peu élevée ; DrCp est indépendant de la température si l'intervalle de température n'est pas trop grand.
DrH°(T) = DrH°(298) ; DrS°(T) = DrS°(298) ; DrG°(T) = DrH°(298)-TDrS°(298).
Qr i est inférieur à K, le système évolue spontanément dans le sens direct.
Dans un nouvel état initial, le système ne contient que 10 moles de méthane et 10 moles d'eau. Déterminer la composition du système à l'équilibre. Ptot = 10 bar. Fractions molaires :
Composition du système à l'équilibre :
DrH° = 206 kJ / mol. : la réaction est endothermique. Une élévation isobare de température déplace l'équilibre dans le sens direct. Au système à l'équilibre on ajoute de façon isotherme et isobare, une mole de monoxyde de carbone. Dans quel sens se produira l'évolution ? Le système évolue dans le sens de la consommation de monoyde de carbone : sens indirect.
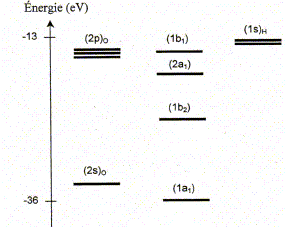
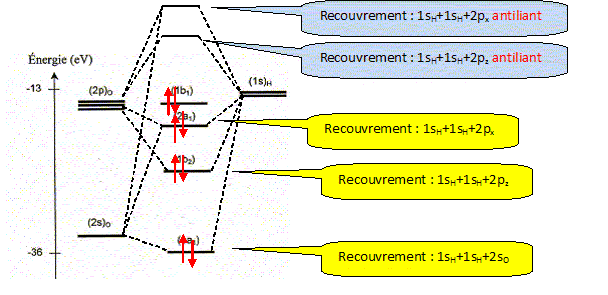
La molécule d'eau. La figure suivante représente la position des niveaux énergétiques des quatre orbitales moléculaires ( OM) de plus basses énergies de la molécule d'eau, ainsi que celle des orbitales atomiques ( OA) de valence de ses atomes constitutifs.
Effectuer le remplissage électronique des niveaux d'énergie. 6 électrons de valence issus de l'atome d'oxygène et 2 électrons issus des 2 atomes d'hydrogène ( 4 paires d'électrons). Combien d'OM de plus haute énergie que celles représentées sur la figure la molécule d'eau comporte t-elle ?
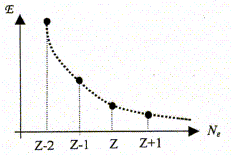
Le traitement quantique du calcul des charges partielles portées par les atomes dans la molécule d'eau s'effectue à partir des intégrales de recouvrement relatives à chacun des OM occupées de la molécule d'eau. Il existe néanmoins des modèles plus simples permettant, moyennant certaines approximations, de déterminer cette répartition des charges. Ce modèle repose sur le concept d'électronégativité d'un édifice polyatomique. Rappeler la définition de l'électronégativité d'un atome isolé. Citer une échelle (autre que celles de Parr et Allred-Rochow décrites ci-dessous) permettant de quantifier ce paramètre. Aptitude que possède un atome à s'approprier le doublet de liaison l'associant à un autre atome. Echelle de Pauling, Soit E l'énergie totale d'un atome isolé, de numéro atomique Z ( Z>> 1). On peut représenter la variation autour de Z de la fonction E= f(Ne) où Ne représente le nombre total d'électrons de l'atome.
L'électronégativité absolue X*
de l'atome isolé peut être définie
( modèle de Parr) comme l'opposé de la pente
de la variation de l'énergie E en fonction du nombre
d'électrons Ne. Par ailleurs on rappelle l'expression du développement limité à l'ordre 2 d'une fonction f(x) au voisinage de x0 : Donner la relation entre l'énergie de première ionisation EI(>0) d'une part et l'affinité électronique AE(>0) de l'atome isolé d'autre part en fonction de E. Energie totale E d'un atome isolé est égale à la somme des énergies Ei de tous les électrons :
ou encore E = E électrons de coeur + xV[-13,6 Z*2 / n*2 ] avec xV : nombre d'électrons de valence. Energie du cation résultant de la perte d'un électron : E = E électrons de coeur + (xV-1)[-13,6 Z1*2 / n*2 ] avec xV : nombre d'électrons de valence. L'énergie d'ionisation est l'énergie de la réaction à l'état gazeux : X--> X+ + e- C'est encore l'opposée de l'énergie orbitalaire de l'électron arraché : EI = 13,6 Z*2 / n*2. et Eaffinité électronique est l'énergie de la réaction à l'état gazeux : X+ e- -->X-. C'est l'énergie qui accompagne la capture d'un électron. En utilisant le développement limité ci-dessus pour E, exprimer X* en fonction de EI et AE. De quelle définition de l'électronégativité cette expression se rapproche t-elle ? Mulliken. Allred et Rochow ont proposé une autre définition de l'électronégativité basée sur la charge effective Zeff du noyau et le rayon covalent ra de l'atome :
Définir la charge effective subie par un électron par rapport au noyau. Quel modèle est utilisé pour estimer sa valeur ? L'attraction entre Z protons du noyau et un électron de l'atome est perturbée par la présence des Z-1 autres électrons répartis entre le noyau et l'électron étudié. Ces Z-1 autres électrons forment un écran : on définit une constante d'écran s ; la charge Z du noyau devient une charge effective Z* relative à l'électron étudié. Z* =Z - s . ( Modèle de Slater). Quelle est la signification physique de l'électronégativité définie par Allred et Rochow ? Force électrostatique attractive exercée entre la charge effective Z* de l'atome et un électron supplémentaire de valence, situé à la distance ra. Dane une entité diatomique AB, si l'atome A est le moins électronégatif et l'atome B le plus électronégatif, alors A acquiert une charge partielle positive et B une charge partielle négative. L'électronégativité de A dans AB augmente par rapport à l'atome isolé et celle de B diminue : l'équilibre de la liaison entre A et B est atteint lorsque les électronégativités de A et B dans AB s'égalisent à une valeur commune, qui constitue l'électronégativité de AB. Considérons un atome j dans un édifice polyatomique. On supposera que la présence des autres atomes induit une perturbation négligeable devant celle due à la charge partielle dj de cet atome. Dans ce cas, on peut exprimer l'électronégativité Xj de j dans l'édifice polyatomique en fonction de la charge partielle dj qu'il porte dans cet édifice et de son électronégativité X*j dans l'atome isolé selon l'équation :
De façon analogue au cas
d'une molécule diatomique, on considèrera que
l'équilibre de la répartition des charges dans
l'édifice polyatomique est atteint lorsque les
électronégativités de chaque atome
s'égalisent à une valeur commune
appelée électronégativité de
l'édifice et notée X. On peut alors
écrire la condition de stabilité de
l'édifice sous la forme Montrer que l'électronégativité X de l'édifice polyatomique de charge totale z s'exprime en fonction des électronégativités des atomes isolés selon l'équation :
Exprimer l'électronégativité de l'eau XH2O en fonction de X*H et X*O. Ici k = 1,36. La somme totale des charges partielles est nulle ; la molécule est électriquement neutre : z = 0.
XH = XH2O = X*H + kdH X*H½ ; 2,5 = 2,1 +1,36*2,1½ dH ; dH = 0,4 /(1,36*1,45) = 0,20. XO = XH2O = X*O + kdO X*O½ ; 2,5 = 3,5 +1,36*3,5½ dO ; dO = -1 /(1,36*1,87) = -0,40. Le moment dipolaire de l'eau liquide vaut 1,85 D ( 1 D = 0,33 10-29 C m ) D'autre part la longueur de la liaison O-H dans la molécule d'eau vaut dO-H= 95 pm et l'angle HOH vaut environ 105 °. Que représente le symbole D ? Debye Représenter la direction du moment dipolaire de la molécule d'eau. Déduire des données ci-dessus les valeurs des charges partielles des atomes dans la molécule d'eau.
m1 = m2 ; m = 2 m1 cos (½a) ; m1 =m / ( 2cos (½a)) = 1,85 / (2*cos (104,5 / 2 )) = 1,52 D. or 1 Debye = 1D = 3,33 10-30 C m d'où m1 =1,52* 3,33 10-30 = 5,06 10-30 C m Pourcentage de caractère ionique : m1 /( e dOH) = 5,06 10-30 / (1,6 10-19 * 96 10-12) = 0,329 ( 33 %). Charge partielle portée par l'atome d'hydrogène : 0,33 e ; par l'atome d'oxygène : -0,66 e.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|