|
QCM chimie concours paramédicaux ( Kiné Poitiers, concours blanc)
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| .
. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Données : masse atomique molaire g.mol-1 : Na = 23 O= 16 H = 1 On dissout 2 mg d'hydroxyde de sodium solide dans 500 mL d'eau à 25°C. Le pH de la solution obtenue est de ; A : 2 ; B = 12 ; C :8 ; D : 10. Analyse : masse molaire NaOH : m = 23+16+1 = 40 g/mol Quantité de matière (mol) : n = m /M = 2 10-3 / 40 =5 10-5 mol ; [HO-] = n/V = 5 10-5 /0,5 =10-4 mol/L Produit ionique de l'eau :
[H3O+] = 10-14 /
[HO-] = 10-14 /
10-4 = 10-10 mol/L ; pH = - log
[H3O+] =
10.
On dose 20 mL d'une solution d'acide chlorhydrique par la soude à 0,01 mol.L-1 en présence de BBT. Le virage de l'indicateur se produit pour un volume de base versé égal à 9 mL . La concentration initiale de l'acide est : A : 90 mmol/L ; B :4,5 mmol/L ; C : 4,5 mol/L ; D : 4,5 10-3 mol/L. Analyse : H3O+aq + HO-aq = 2H2O. Ca = Cb Vb / Va =0,01*9 / 20 =4,5 10-3 mol/L = 4,5 mmol/L.
Données: pKa 1 (NH4+/ NH3 ) = 9,2 ; pKa 2 (HPO42-/PO43-) = 12,4. Un litre de solution d'engrais pour plante est préparé en dissolvant 0,1 mol de phosphate d'ammonium solide (NH4)3PO4 dans la quantité d'eau nécessaire. La réaction entre les ions ammonium et phosphate est NH4+ + PO43- = HPO42- + NH3 A : La valeur initiale du quotient de réaction vaut quasiment 0, B : La valeur du quotient de réaction dans l'état d'équilibre vaut environ 1580, C : Le système évolue dans le sens direct, D : La réaction est totale. Analyse : La dissolution complète du solide conduit à : (NH4)3PO4 (s) = 3NH4+aq+PO43-aq. soit 0,3 mol d'ion NH4+aqet 0,1 mol PO43-aq. Qr i = [HPO42-]i[NH3]i /([NH4+]i[PO43-]i) ~0 *0 /(0,3*0,1) ~ 0. A est vraie. Qr éq =K = [HPO42-]éq[NH3]éq /([NH4+]éq[PO43-]éq) Qr éq =K = [HPO42-]éq[NH3]éq /([NH4+]éq[PO43-]éq)
Qr i < K, le critère d'évolution spontané indique une évolution dans le sens direct. C est vraie. x2éq = 1584 x2éq -633,6xéq +47,52 ; xéq ~ 0,1 mol, c'est à dire très proche de xmax. D est vraie.
Electrolyse 1 Faraday = 9,65.104 C.mol-1. Masse molaire en g.mol-1: Cu = 63,5 Ag = 107,8 Deux électrolyseurs à électrodes de platine sont montés en dérivation. Le premier contient une solution concentrée de nitrate de cuivre II et le deuxième une solution de nitrate d'argent. On effectue l'électrolyse en maintenant constante l'intensité. Au bout de 8 min, les masses des dépôts d'argent et de cuivre sont respectivement de 0,98 g et 0,32 g. Calculer l'intensité dans le circuit principal. A : 3,86 A ; B : 2,03 A ; C : 1,83 A ; D : 0,02 A. Analyse : Cu2+ +2e- = Cu(s) ; Le premier : n(e-) = 2n(Cu(s)) = avec n(Cu(s)) = m/M = 0,32/63,5 mol ; n(e-) =2*0,32/63,5~ 0,01 mol. La charge, en valeur absolue, d'une mole d'électrons vaut 1 Faraday = 9,65.104 C Quantité d'élctricité Q = 9,65.104 *0,01 = 9,72.102 C intensité I1 = Q/t avec t = 8*60 = 480 s. I1 = 972/480~ 2,03 A. Ag+ +e- = Ag(s) ; Le second : n(e-) = n(Ag(s)) = avec n(Ag(s)) = m/M = 0,98/108 mol ; n(e-) =0,98/108~ 9,07 10-3 mol. La charge, en valeur absolue, d'une mole d'électrons vaut 1 Faraday = 9,65.104 C Quantité d'élctricité Q = 9,65.104 *9,07 10-3 = 8,75.102 C intensité I2 = Q/t avec t = 8*60 = 480 s. I2 = 875/480~ 1,83A. Les intensités dérivées s'ajoutent : I1+I2 = 3,86 A.
Données : masse atomique molaire g.mol-1 Ag =108 ; un faraday = 96500 Coulombs masse volumique de l'argent est : µ =10500 kg.m-3. L'une des 2 électrodes est constituée par l'objet métallique. L'électrolyte est une solution de sulfate d'argent (I). La surface à argenter est 0,25 m2, l'épaisseur de la couche à déposer est égale à 0,015 mm. L'intensité du courant qui traverse l'électrolyseur est 60 A. La durée de l'électrolyse pour effectuer ce dépôt est: A : 9 min47s ; B : 84,6 h ; C : 304,6 min ; D :15 min. Analyse : Volume de la couche d'argent : 0,015 = 1,5 10-5 m ; V = 0,25*1,5 10-5 =3,75 10-5 m3. Masse dargent : m = V µ =3,75 10-5 *10500 =3,94 10-2 kg = 39,4 g. Quantité de matière d'argent : n(Ag) = m/M = 39,4 / 108 =0,365 mol Ag+ +e- = Ag(s) ; n(e-) = n(Ag(s)) =0,365 mol Quantité d'élctricité Q = 9,65.104 *0,365 = 3,52.104 C durée = Q/I = 3,52.104 /60 =586 s = 9,77 min = 9 min 47 s.
oxydation de l'éthanol par le permanganate de potassium. Une solution alcoolique contient 40 g d'éthanol par litre. A 5 mL de cette solution initiale, on ajoute une solution acidifiée de permanganate de potassium de concentration 0,2 mol / L. Quel volume minimal de solution de permanganate faut-il utiliser pour oxyder tout l'éthanol en acide éthanoïque ? (mL) A : 17,4 ; B : 13,3 ; C: 22,7 ; D : 21,7 Analyse : 4 fois { MnO4- + 8 H+ + 5e- = Mn2+ + 4H2O } 5 fois { C2H5OH + H2O = CH3COOH + 4e-+ 4 H+ } 4 MnO4- + 12 H+ + 5C2H5OH = 4Mn2+ + 11H2O + 5CH3COOH. Quantité de matière à l'équivalence : n(MnO4- ) =4/5n(C2H5OH) = 0,8 n(C2H5OH). M(éthanol) = 46 g/mol ; n(C2H5OH) =m/M = 40/46=0,8695 mol dans 1L soit 0,8695*5/1000 = 4,35 10-3 mol dans 5 mL. n(MnO4- ) =
0,8 *4,35 10-3 =3,4810-3 mol ; volume
= n/C = 3,4810-3 /0,2 =1,74 10-2 L =
17,4
mL.
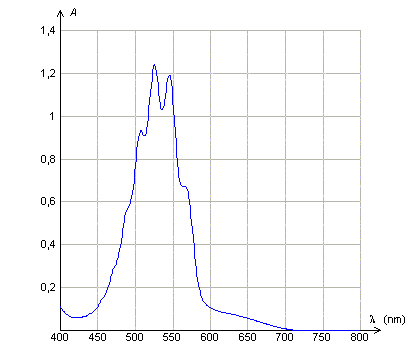
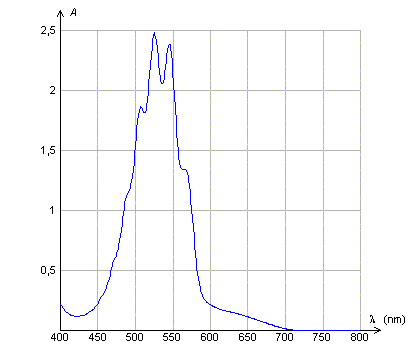
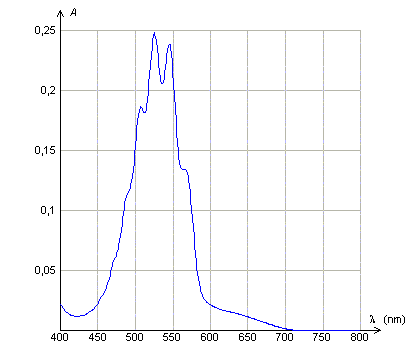
Loi de Beer Lambert. Données : La loi de Beer- Lambert dit que l'absorbance d'une solution diluée A, est proportionnelle à la concentration molaire volumique du soluté et à l'épaisseur de solution traversée et que A dépend de la longueur d'onde du rayonnement monochromatique incident . Les courbes suivantes sont tracées avec des solutions de permanganate de potassium de concentration molaire volumique C. Quelle(s) réponse(s) est (sont)vraie(s) ?
A : Le maximum d'absorbance de la solution de permanganate de potassium se situe dans le rouge. Faux. L'absorbance est maximale entre 500 et 550 nm ( vert ). B : L'épaisseur de la solution traversée étant 1 cm, la solution utilisée ( courbe 2) est dix fois plus concentrée que la solution utilisée (courbe 3). Vrai. L'absorbance est proportionnelle à la concentration, pour une longueur d'onde et une épaisseur données. C : A concentration égale, l'épaisseur de solution traversée ( courbe 1 ) est le double de celle traversée (courbe 2). Faux. L'absorbance est proportionnelle à l'épaisseur, pour une longueur d'onde et une concentration données. D : L'abscisse du pic d'absorption est indépendant de la concentration de la solution utilisée et de l'épaisseur de solution traversée. Vrai. Elle ne dépend que de la nature de la solution.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
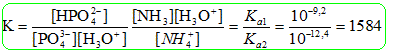 B
est vraie.
B
est vraie.