|
Solubilité de l'acide salicylique ( concours manipulateur radio Tours 2009)
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||
| .
. |
|||||||
|
|||||||
|
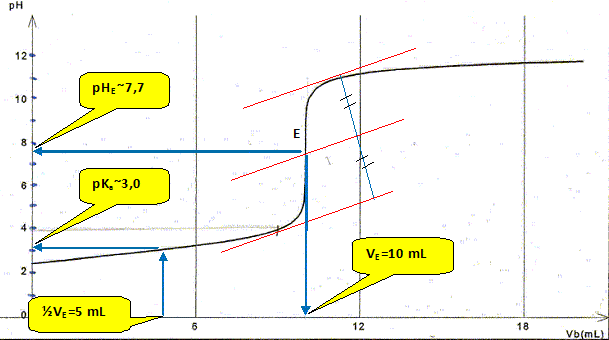
On cherche sa solubilité dans I'eau à 25°C. Données : masse molaire M = 138 g/mol ; pKe = 14,0 à 25°C pour Ie couple C7H603 (aq) / C7H503 3-(aq): pKa,= 3,0 à 25°C Aide aux calculs : 5/3 = 1,667 ; 138*5/3 ~230 ; 138*3/5 = 82,8 On introduit 5,0 g d'acide salicylique dans un litre d'eau à 25°C. On agite pendant 15 min, puis on filtre pour éliminer I'acide qui ne s'est pas dissous. On prélève V = 15,0 mL de la solution S obtenue que l'on titre avec une solution d'hydroxyde de sodium (Na+(aq) + HO-(aq) ) de concentration cb = 2,5.10-2 moI.L-1. Le titrage pH-métrique conduit au document suivant ( que l'on a complété pour répondre à certaines questions)
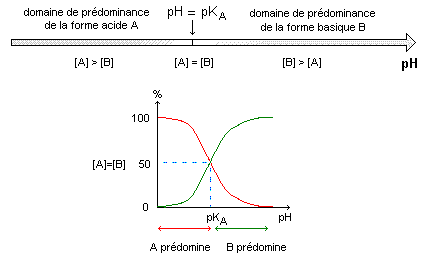
D'après Ie document ci-dessus, quel est le pH de la solution S ? Lecture graphe pour un volume Vb=0 : pH ~2,4. Quelle est I'espèce qui prédomine dans la solution S : AH ou A- ? Justifier. A pH inférieur à pKa ( pH =2,4 est inférieure au pKa =3) , la forme acide AH aq prédomine.
Ecrire l'équation de la réaction mise en jeu dans le titrage : réaction entre AH(aq) et HO-(aq). AH(aq) + HO-(aq) = A-(aq) + H2O(liq) Calculer la constante d'équilibre associée à cette équation.
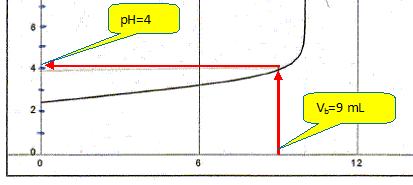
La constante étant très grande la réaction est totale. Quel est le pH du mélange obtenu lorsqu'on a versé un volume Vb = 9,0 mL de solution d'hydroxyde de sodium ?
En déduire la concentration molaire volumique en ions oxonium dans ce mélange. [H3O+aq]= 10-pH =1,0 10-4 mol/L. Calculer le rapport des concentrations [A- ]/[AH] dans ce mélange. pH = pKa + log ([A- ]/[AH]) ; log ([A- ]/[AH]) = pH-pKa = 4-3 = 1 ; [A- ]/[AH] = 10.
|
|||||||
|
|
|||||||
|
|