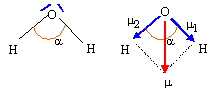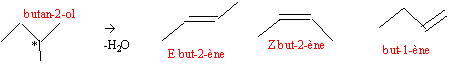|
exercice 2 : formule d'un composé contenant les éléments C, H, O |
||
|
||
|
On représente un atome par la notation AZX.
corrigé |
||
|
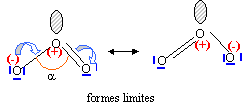
A : nombre de masse ( nombre de nucléons) ; Z : numéro atomique ( nombre de charge, nombre de protons) le nombre de neutrons est égal à A-Z masse molaire de l'élément oxygène : x17 = 0,00037 ; x16 + 0,00037 + x18 = 1. x16 + x18 = 0,99963 (1) 0,00037 * 16,99914 + 15,99491 x16 + 17,99916 x18 = 15,9994 15,99491 x16 + 17,99916 x18 = 15,9931. (2) x16 = 0,99963- x18; repport dans (2). 15,99491 (0,99963- x18) + 17,99916 x18 = 15,9931. x18 = 0,205 % ; x16 = 99,758 %. configuration électronique de l'élément oxygène : 1 s² 2s² 2p4. soit 6 électrons externes sur la couche de valence : il manque deux électrons pour saturer la couche à huit électrons ( régle de l'octet) c'est un élément électronégatif. l'élément oxygène à tendance à gagner ces deux électrons lors des réactions chimiques, soit en formant un ion O2- (composé ionique Na2O) soit en mettant en oeuvre deux liaisons de covalence.(composé covalent CH3-OH) molécule d'ozone O3 : la molécule n'est pas cyclique. l'atome central est un atome d'oxygène : deux directions de liaisons ( une liaison simple et une liaisons double plus volumineuse que la liaison simple) un doublet non liant d'où la géométrie de type AX2E : triangulaire plane l'angle a est un peu inférieur à 120° du fait de la répulsion du doublet non liant sur des liaisons O-O
les deux liaisons O-O sont identiques (même longueur) légerement plus longues que dans le dioxygène O=O.
molécule d'eau H2O : l'atome central est un atome d'oxygène : deux directions de liaisons ; deux doublets non liants d'où la géométrie de type AX2E2 : tétraèdre déformé l'angle a est un peu inférieur à 109° du fait de la répulsion des doublets non liants sur des liaisons O-H
m = 2 m1 cos (½a) = 2* 5,12 10-30 cos (104,5 / 2 ) = 6,27 10-30Cm or 1 Debye = 1D = 3,33 10-30Cm m = 1,88 D.
|
||
|
Déterminer la formule brute d'un composé
contenant C, H et O.
corrigé formule brute CxHyO z ; masse molaire M = 12 x + y + 16z. équation bilan de la combustion : CxHyO z +( x + 0,25y -½ z)O2 --> x CO2 + ½y H2O en conséquence n C = n CO2 = 15,4 10-3 / 44 = 0,35 10-3 mol = 0,35 mmol soit 12*0,35 = 4,2 mg de C ou 4,2 *100 / 6,51 = 64,51 % C. nH = 2 n H2O = 2* 7,9 10-3 / 18 = 0,878 10-3 mol = 0,878 mmol soit 1*0,878 = 0,878 mg H ou 0,878*100/6,51 = 13,48 % H 100-13,48-64,51
= 22,01
% O.
PV = nRT = 0,245 /M RT d'où M =0,245 RT / PV M
=0,285*8,314*473 / ( 105 *0,15 10-3) =
74,7
g/ mol.
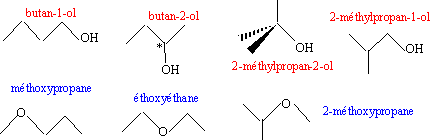
y / 13,48 = 74,7/100 d'où y = 10 16 z / 22,01 = 0,747 d'où z = 1 C4H10O : le nombre d'insaturation est égal à (2x+2 -y)/2 =0 il s'agit
d'un composé saturé ( pas de liaison multiple
ou de cycle) : alcool ou étheroxyde.
la déshydratation du butan-1-ol conduit à un seul alcène le but-1-ène. la déshydratation du butan-2-ol conduit à :
|