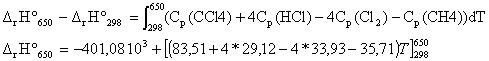|
exercice 1 : énergie de liaison |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Soit réaction suivante : CH4 (g) + 4 Cl2 (g) --> CCl4(g) + 4 HCl (g) DrH° = -401,08 kJ/mol à 298 K.
données : DH° (C-H) = 415 kJ / mol à 298 K enthalpie molaire de vaporisation du trichlorométhane : 30,4 kJ/mol
corrigé écrire la loi de Kirchhoff pour calculer l'enthalpie standart de la réaction à 650 K :
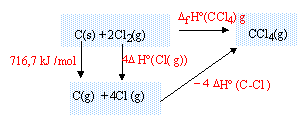
DfH° (650 K) = -401,08 103 + 28,56*(650-298) = -391,03 kJ/mol. enthalpie standart de formation CCl4 (g): DfH° (298 K) = 4DfH° (HCl(g))+DfH° (CCl4(g))- 4 DfH° (Cl2(g))-DfH° (CH4(g)) DfH° (CCl4(g)) = DfH° (298 K) - 4DfH° (HCl(g)) + 4 DfH° (Cl2(g))+DfH° (CH4(g)) DfH° (Cl2(g)) = 0 corps pur simple dans son état de référence DfH° (CCl4(g)) = -401,08 -4*(-92,3) + 4*0 +(-74,6) = -106,48 kJ/mol. énergie de la liaison C-Cl : réaliser un cycle thermochimique :
DfH° (CCl4(g)) = 716,7 + 4DfH° (Cl(g))-4 DfH° (C-Cl) DfH° (C-Cl) = 0,25 * 716,7+ 121,3 - 0,25*(-106,48) = 327,1 kJ/mol. enthalpie standart de formation CHCl3 : réaliser un cycle thermochimique :
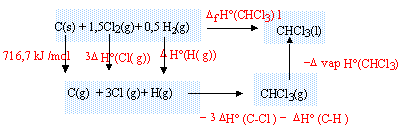
DfH° (CHCl3(l)) = 716,7 + 3DfH° (Cl(g))+DfH° (H(g))-3DfH° (C-Cl)-DfH° (C-H)-DvapH° (CHCl3) DfH° (CHCl3(l)) =716,7+3*121,3 + 218-3*327,1-415-30, 4 = -128,1 kJ/mol. |
||||||||||||||||||||||
|
|
||||||||||||||||||||||
données à 298 K : enthalpie standart de liaisons (kJ/mol) : C-C : 345 ; C-H : 415 ; H-H : 436 ; O=O : 495. enthalpie molaire standart de formation (kJ/mol) : C(g) : 716,6. capacité calorifique molaire (J K-1 mol-1) : CO2 (g) : 37,1 ; H2O(liq) : 75,47 ; H2O(g) : 33,5 ; N2(g) : 29,1 ;
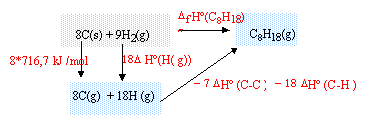
corrigé enthalpie formation standart de l'octane : réaliser un cycle thermochimique :
DfH° (C8H18) = 8*716,7+18DfH° (H(g))- 7 DfH° (C-C)-18DfH° (C-H) DfH°
(C8H18) = 5733,6 +18*218 -7 *345
-18*415 = -227,4
kJ/mol.
C8H18 (g) + 12,5 O2 (g)-->8 CO2 (g) + 9 H2O (g) DrH° comb = 9DfH° (H2O(g))+8 DfH° CO2 (g) - DfH° C8H18(g) DfH° (O2(g)) = 0 corps pur simple dans son état de référence DrH° comb = 9
* (-241,83)+ 8*(-393,5) +227,4 =
-5097
kJ/mol.
la combustion étant totale et rapide le système peut être considéré comme adiabatique. l'énergie libérée par la combustion échauffe les produits de la combustion : la combustion se fait avec l'air, 12,5 *4 = 50 mol de diazote sont présentes dans les produits. 8 CO2 (g) + 9 H2O (g) + 50 N2(g) Le volume est constant, il faut chercher l'énergie interne de la combustion. pour une réaction en phase gazeuse : DrU° = DrH° - Drn(g) RT Drn(g) = 8+9-12,5-1 = +3,5 mol DrU° = - 5,097 106 - 3,5*8,31*298 = -5,105 106 J/mol. capacité calorifique à volume constant : Cv = Cp-R capacité calorifique molaire (J K-1 mol-1) : CO2 (g) : 37,1 ; H2O(liq) : 75,47 ; H2O(g) : 33,5 ; N2(g) : 29,1 ;
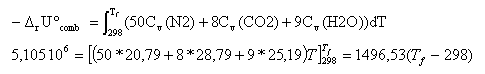
Tf = 3709
K.
loi des gaz parfaits : Pf V = n RTf. Tf = 3709 K ; V = 0,05 m3 ; n = 50+8+9 = 67 mol de gaz après combustion Pf = 67*8,31*3709/ 0,05 = 413 bars. |