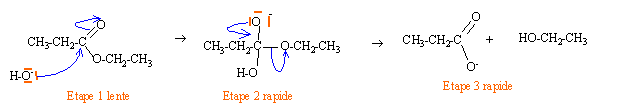|
sage
femme Ile de
France
2001
|
||||||||||||||||||||||||||||||||||||
|
On étudie la réaction de saponification du propanoate d'éthyle avec l'hydroxyde de sodium (soude). On dissout 8 10-3 mol de l'ester dans de l'eau, on y ajoute de la soude pour ajuster le pH à 12 à 25°C.
corrigé |
||||||||||||||||||||||||||||||||||||
|
site nucléophile : atome d'oxygène de l'ion HO- , atome d'azote, atome possédant un excès d'électrons. étape 1 lente, limitant la vitesse de la réaction : attaque nucléophile sur le carbone du groupe ester l'intermédiaire réactionnel est tétraédrique étape 2 rapide : cet intermédiaire évolue rapidement vers la formation d'un ion alcoolate et d'acide propanoïque étape 3 rapide : réaction acide base exothermique, d'une part entre l'acide propanoïque et l'ion hydroxyde conduisant à l'ion propanoate d'autre part entre l'ion alcoolate, base forte et l'eau conduisant à l'alcool éthylique
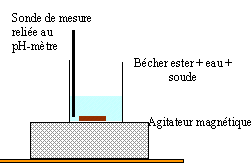
montage permettant le suivi du pH :
CH3-CH2-COO-CH2-CH3 + HO- donne CH3-CH2-COO- + CH3-CH2-OH La quantité de matière d'alcool formé est égale à la quantité de matière d'ion HO- ayant réagi : [HO-]départ = 0,01 mol/L car pH = 12 [HO-] date t = 10-14+pH mol/L [alcool]date t = 0,01 -10-14+pH mol/L
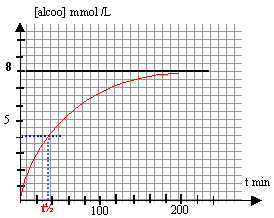
à partir de 0,008 mol d'ester on peut former 0,008 mol d'alcool : la réaction n'est pas terminée à t = 120 min. pH final : 0,008 mol de soude a été consommé par 0,008 mol d'ester ; il en reste : 0,01-0,008 = 0,002 mol dans 1L pH = 14 + log 0,002 = 11,3.
le temps de demi réaction correspond à 4 mmol/L d'alcool formé en partant de 8 mmol/L d'ester il est voisin de 35 min.
retour - menu |