|
concours Kiné Assas 2002 |
|||
|
|||
|
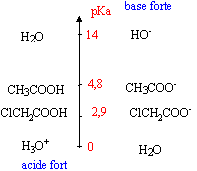
On considère trois solutions aqueuses de même pH =2,7. La première est une solution d'acide monochloroéthanoïque de concentration 5 10-3 mol/L, la seconde une solution d'acide éthanoïque de concentration 0,25 mol/L et la troisième une solution d'acide chlorhydrique de concentration 2 10-3 mol/L.
corrigé
CH3-COOH acide éthanoïque [H3O+]= 10-pH = 10-2,7 = 2 10-3 mol/L les trois solutions ayant le même pH, la concentration en ion oxonium est la même dans les trois solutions. l'acide chlorhydrique est un acide fort pour lequel pH= -log C. pour les deux autres solutions ( solutions d'acide faibles), on cherche le pourcentage de molécules dissociées solution d'acide éthanoïque : 2 10-3/ 0,25 = 8 10-3 ou 0,8% solution d'acide monochloroéthanoïque : 2 10-3/ 5 10-3 = 0,4 ou 40% plus il y a de molécules dissociées en ion oxonium , plus l'acide faible est fort. l'acide de la première solution est plus fort que l'acide de la seconde solution pH= pKa + log [ClCH2COO-] / [Cl-CH2-COOH] pKa = 2,7 - log [ClCH2COO-] / [Cl-CH2-COOH] [ClCH2COO-] = [H3O+] = 2 10-3 mol/L conservation de l'élément chlore : [ClCH2COO-] + [Cl-CH2-COOH] = 5 10-3 mol/L [Cl-CH2-COOH] = 3 10-3 mol/L pKa = 2,7 - log 2/3 = 2,88.
le classement ci-dessus est en accord avec les pKa.
l'atome de chlore par effet inducteur déplace vers lui les électrons des doublets de liaisons et en conséquence l'atome d'hydrogène du groupe -COOH est plus mobile. L'acide monochloroéthanoïque est plus fort que l'acide éthanoïque.
|
|||
|
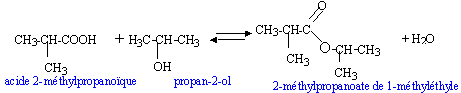
L'hydrolyse d'un ester de formule brute C7H14O2 fournit de l'acide 2-méthylpropanoïque et un alcool A. Par oxydation ménagée de A on obtient un produit B qui agit positivement sur la DNPH mais est sans action sur la liqueur de Fehling.
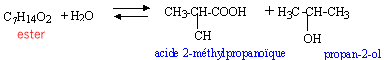
Le produit B est une cétone car le test est positif avec la DNPH, mais négatif avec la liqueur de Fehling l'alcool A est un alcool secondaire, le propan-2-ol.
retour - menu |