|
aide technique 2002 |
||||||||||||||||||||
|
||||||||||||||||||||
|
préparation d'une solution : masse atomique molaire (g/mol) : H=1 ; N= 14 ; Cl=35,5. On désire préparer deux solutions, l'une de chlorure d'ammonium NH4Cl ( solution A), l'autre d'ammoniac NH3 ( solution B), toutes deux de concentration 0,1 mol/L.
corrigé masse molaire NH4Cl anhydre : 14 + 4 +35,5 = 53,5 g/ mol il faut peser : 0,1*53,5 = 5,35 g à la balance électronique. le facteur de dilution est égal à 10 : il faut donc prélever 20 mL de solution mère à l'aide d'une pipette graduée + pipeteur et utiliser une fiole jaugée de 200 mL ( on complétera jusqu'au trait de jauge avec de l'eau distillée) avec la solution d'ammoniac à 1 mol/L mettre des gants, des lunettes et travailler éventuellement sous hotte aspirante.
|
||||||||||||||||||||
|
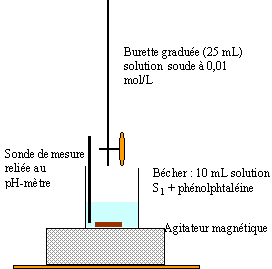
dosage d'un vinaigre: Données : masse atomique molaire (g/mol) C=12 ; H=1 ; O=16. L'étiquette d'une bouteille de 1L de vinaigre indique 6°. Le degré d'acidité est la masse d'acide éthanoïque pur présent dans 100 g de vinaigre. On considère le vinaigre comme une solution aqueuse d'acide éthanoïque. On souhaite déterminer la concentration molaire volumique en acide éthanoïque, notée C, de ce vinaigre.
corrigé
à l'équivalence on a une solution d'éthanoate de sodium ; cette solution contient l'ion éthanoate, une base faible : donc le pH est supérieur à 7. la zone de virage de l'indicateur coloré doit contenir le pH du point équivalent : donc phénolphtaléine. 0 l'quivalence CaVa = CbVb soit Ca = C1 = 0,01*10,8 /10 = 0,0108 mol/L en tenant compte du facteur de dilution : C= 100 C1 = 1,08 mol/L masse molaire acide éthanoïque CH3COOH : 60 g/mol masse d'acide éthanoïque dans 1 L de vinaigre : 1,08*60 = 64,8 g ou encore 6,48 g dans 100 mL de vinaigre soit 6,48 °. du même ordre de grandeur que l'indication portée sur l'étiquette
|
||||||||||||||||||||
|
Identification de composés organiques : L'ion dichromate appartient au couple Cr2O72- /Cr3+. On dispose de 4 flacons contenant l'un des composés dont les formules semi-séveloppées sont données ci-dessous : 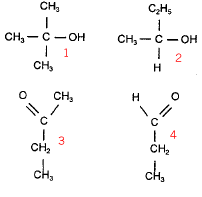
ce dernier
ne subit pas d'oxydation ménagée par l'ion
dichromate et les deux tests suivants seront négatifs
: donc A.
l'oxydation ménagée de ce dernier par l'ion dichromate conduit à la butanone ( celle ci donne un test positif avec la DNPH, mais négatif avec la liqueur de Fehling) donc D.
pas
d'oxydation ménagée avec l'ion dichromate,
test positif avec la DNPH, négatif avec la liqueur de
Fehling : donc C.
ce dernier est oxydé en acide propanoïque par l'ion dichromate l'aldehyde donne un test positif avec la DNPH et un test positif avec la liqueur de Fehling : donc B.
retour - menu |