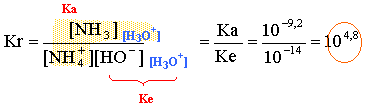|
suite --> charge décharge d'un condensateur (concours Geipi 02)
|
||||||||||||||||||||||||||||||||||||||||||||
|
Les questions peuvent dans une large mesure être abordées indépendamment. On dispose d'une solution aqueuse de nitrate d'ammonium NH4NO3 : solution S de concentration inconnue.
Données : l'acide nitrique HNO3 est un acide fort dans l'eau. pKa ( NH4+ / NH3) = 9,2
ion nitrate NO3- , ion ammonium NH4+, ion hydroxyde HO-, ion oxonium H3O+ , eau et la base conjuguée de l'ion ammonium NH3. la solution contient un acide faible, l'ion ammonium : le pH est donc inférieur à 7, milieu acide. équation bilan de la réaction de dosage : NH4+ + HO---> NH3 + H2O
Qté de matière de soude dans 0,5L : 0,025*0,5 = 0,0125 mol mass e soude = 0,0125 *(23+16+1) = 0,5 g. la zone de virage doit contenir le pH du point équivalent : à l'équivalence la solution contient la base faible NH3, donc le pH est supérieur à 7 indicateur coloré possible : jaune d'alizarine. la solution titrante est ajoutée progressivement à l'aide d'une burette graduée. à
l'équivalence CaVa = CbVb d'où Ca = 0,025*24
/20 = 0,03
mol/L.
la solution est électriquement neutre : [NH4+ ] + [Na+] + [H3O+] = [HO-] +[ NO3-] [Na+] = 0,025*24/(20+24) = 1,364 10-2 mol/L [ NO3-] = 0,03*20/(20+24) = 1,364 10-2 mol/L d'où [NH4+ ] + [H3O+] = [HO-] l'ion oxonium est minoritaire en milieu basique :[NH4+ ] voisin [HO-] constante d'acidité : 10-9,2 = [NH3][H3O+] / [NH4+]=1,364 10-2[H3O+] /[HO-] 10-9,2 =1,364 10-2[H3O+]² / 10-14 [H3O+]² =10-9,2 *10-14 /1,364 10-2 =4,63 10-22 soit [H3O+] =2,15 10-11 mol/L pH = 10,67. retour - menu |