|
|
|
|
|
|
- Le technécium 99 est un émetteur
b- dont la
durée de vie est très grande. Un
échantillon de technécium voit son
activité divisée par 5 en 490 000 ans. On
admettra qu'un échantillon radioactif n'est plus
dangereux au bout d'un temps égal à 10 fois
sa demi-vie.
- Déterminer le temps (en milliers d'années) au bout duquel l'échantillon peut-être considéré comme inoffensif.
980 ; 1240 ; 1960 ; 2110 ; 2300 ; 2650. - Parmi les affirmations suivantes, combien y en a-t-il
d'exactes ?
- Parmi deux échantillons radioactifs possédant le même nombre initial de noyaux radioactifs, celui qui a la demi-vie la plus courte a une plus grande activité.
- Au bout d'un temps égal à 4 fois sa demi-vie, l'activité d'un échantillon d'un isotope radioactif a été divisée par 16.
- L'unité de la constante radioactive l est la seconde.
- La tangente à une courbe de décroissance radioactive à l'instant t=0 coupe l'axe des abscisses au point t = T/ln 2 où T désigne la demi-vie de l'isotope radioactif considéré.
- L'activité d'un échantillon à un instant donné est proportionnelle au nombre de noyaux radioactifs contenus dans cet échantillon à l'instant considéré. - Dans un réacteur nucléaire les noyaux
d'uranium 235 subissent la fission sous le choc d'un
neutron lent. On considerera la réaction suivante
:
23592U+01n-->14054Xe
+ 94xSr + y
01n
Données : masse d'un neutron : 1,00866 u ; masse 23592U : 234,99332 u ; masse 94xSr :93,89446 u ; masse 14054Xe : 139,89194 u ; 1 u = 1,66054 10-27 kg ; c = 3 108 m/s ; 1eV = 1,6022 10-19 J ; NAvogadro = 6,022 1023 mol-1; pouvoir calorifique du pétrole : P=43 MJ/kg ; masse molaire de l'uranium 235 : M=235 g/mol.
Un réacteur nucléaire fourni une puissance électrique moyenne de 950 MW. On suppose que cette puissance électrique fournie par le réacteur est constante dans le temps. Le rendement de la transformation énergie nucléaire en énergie électrique est de 35 %.
- Après avoir équilibré l'équation bilan précédente, donner les valeurs de x et de y.
- Calculer l'énergie libérée par la fission d'un noyau d'uranium 235 suivant la réaction proposée.
- On admettra que toutes les réactions de fission produisent la même énergie que la précédente.
- Déterminer la masse ( en kg) d'uranium 235 consommée par le réacteur en une journée.
- Déterminer la masse de pétrole ( en tonnes) qu'il faudrait brûler pour produire la même énergie qu'un kg d'uranium.
- Calculer la date Dt ( en heures et minutes) nécessaire pour consommer un kilogramme d'uranium 235 dans ce réacteur.
corrigé
A = A0 e-l t avec l T= ln2
ln (A0 / A) = l t avec A0 / A = 5 si t = 4,9 105 ans
ln 5 =l*4,9 105 soit l= 3,284 10-6 an-1.
T = ln2 / l= 0,693 / 3,284 10-6 = 2,11 105 ans
10 T = 2,11 106 ans = 2110 milliers d'années.
* N= N0 e -lt.
activité A = -dN/dt = -N0 (-l) e -lt=lN ou bien à t=0 : A0 = lN0.
or l T=ln2 ( T période ou demi-vie ; l constante radioactive)
A0 = N0ln2 / T
l'activité initiale est d'autant plus grande que la demi-vie est plus courte.
* l'activité est divisée par 24 = 16 au bout de 4 périodes.
* l'unité de la constante radioactivelest l'inverse d'un temps.
* dN/dt = N0 (-l) e -lt; à l'instant initial dN/dt = -N0l. ( coefficient directeur de la tangente à la courbe de décroissance radioactive à t=0)
Cette tangente passe également par le point (0, N0)
d'où son équation : N=-N0l t + N0.
N= 0 si t = 1/l .
or l T=ln2 soit t = 1/l = T / ln 2.
*A= lN l'activité à la date t est proportionnelle au nombre de noyaux présents à l'instant t
23592U+01n-->14054Xe + 94xSr + y 01n
conservation de la charge : 92 = 54+x d'où x = 38
conservation du nombre de nucléons : 235+1=140+94+y d'où y=2.
variation de masse |Dm|=|139,89194+93,89446+1,00866-234,99332|=0,19826 u
soit 0,19826*1,66 10-27 = 3,29 10-28 kg
énergie libérée par fission : E=Dmc² = 3,29 10-28 *(3 108)² =2,96 10-11 J
2,96 10-11/ 1,6 10-19 = 1,85 108 eV = 185 meV.
énergie libérée par 235 g d'uranium 235 ( une mole) : 2,96 10-11*6,02 1023 = 1,78 1013 J /mol
énergie libérée par kg d'235 U : 1,78 1013 *1000 / 235 = 7,58 1013 J/kg.
énergie nucléaire libérée en 24 h : puissance (W) * temps (s) / rendement
9,5 108 *24*3600 / 0,35 = 2,345 1014 J
masse d'235 U consommée par jour : 2,345 1014 / 7,58 1013 = 3,1 kg.
1 kg d'uranium libère : 7,58 1013 J
diviser par le pouvoir calorifique du pétrole 4,3 107 J/kg :
7,58 1013 / 4,3 107 =1,76 106 kg = 1760 tonnes de pétrole.
durée pour consommer 1 kg d'uranium :
3,1 kg consommé par 24 h soit 24 / 3,1 = 7 H 45 min.
- Une bille d'acier sphérique de rayon r= 4 cm
tombe verticalement dans l'air à vitesse constante
V. l'air exerce sur la bille une force de frottement
fluide qui a pour expression F=Kpr²
rair V²
où K est une constante. On négligera la
poussée d'Archimède s'exerçant sur
la bille. rair =
1,29 kg/m3 ; racier
= 7800 kg/m3 ; K=0,2.
- Déterminer l'énergie cinétique (J) de la bille en arrivant au sol .
165 ; 2,47 ; 2,88 ; 3,15 ; 3,35 ; 3,62. - La période de révolution d'un satellite
en orbite circulaire autour de la terre est T= 5548 s. On
place le satellite sur une orbite circulaire, la
période du satellite augmente de 8%.
G= 6,67 10-11 SI ; MT= 5,98 1024 kg ; RT= 6370 km.
- Déterminer l'altitude (en km) du satellite sur sa nouvelle orbite.
348 ; 532 ; 762 ; 896 ; 1023 ; 1230. - Un solide S de masse m glissant sans frottement sur
une tige horizontale, est accroché à un
ressort idéal de raideur k dont l'autre
extrémité est fixée à un
support. La position du centre d'inertie G du solide
à l'équilibre constitue l'origine O de
l'axe des abscisses. On écarte le solide de sa
position d'équilibre, de 5 cm dans le sens des
abscisses et on le libère sans vitesse initiale.
L'origine des temps sera prise au premier passage du
centre d'inertie à la position d'équilibre.
L'énergie du système {solide + ressort} est
constante et égale à 20 mJ. A la date t= 50
ms, l'énergie potentielle élastique du
système est de 4,9 mJ.
- Déterminer la masse ( en g) du solide.
50 ; 100 ; 150 ; 200 ; 250 ; 300.
corrigé
valeur de la vitesse constante, donc mouvement uniforme; de plus le mouvement est rectigne.
Le principe d'inertie ( 1ère loi de Newton) indique que la somme des forces appliquée s à la bille est nulle.
valeur du poids =valeur des frottements soit mg = Kpr²rair V²
avec m (kg ) =masse volumique acier fois volume de la bille (m3)
m= racier 4pr3/3
racier 4pr3/3 g= Kpr²rair V² d'où V² = 4rracier g / (3Krair)
V² = 4* 4 10-3 *7800*9,8 / (3*0,2*1,29) = 1580,16 m²/s²
masse de la bille = racier 4pr3/3 = 7800*4*3,14*(4 10-3)3/3 = 2,09 10-3 kg
énergie cinétique = ½mV² = 0,5
*2,09 10-3 *1580,16 =
1,651
J.
Nouvelle période T1 = 1,08 T =
1,08*5548 = 5991,84 s.
3ème loi de Kepler : T²/h3 =4p²/(GM)
4p²/(GM) = 9,887 10-14.
T1²/h13 = 9,887 10-14 d'où h13 = T1² / 9,887 10-14 = 3,63 1020.
h1 = 7134,3 km; il suffit de retrancher le
rayon terrestre (6370 km) pour obtenir l'altitude par
rapport au sol : 764
km.
Energie mécanique EM=
énergie cinétique Ec + énergie
potentielle élastique Ep
EM= ½mv² + ½kx²
si x= 0,05 ( l'amplitude) Em est sous forme d'énergie potentielle élastique : 0,02 = ½ka²
k = 2*0,02 / (0,05)² = 16 N/m.
à t = 50 ms : ½kx² = 4,9 10-3 J d'où x² = 9,8 10-3 /16= 6,125 10-4 m² ; x= 2,475 10-2 m.
x(t) = a sin (w0t) à t = 0 x(t=0) doit être nul.
x(t=0,05 ) = 2,475 10-2 = 0,05 sin(w0*0,05)
sin(w0*0,05) = 0,495 = sin 0,518 (rad) soit w0*0,05 =0,518
w0= 0,518/0,05 = 10,356 rad/s.
or w²0= k /m
d'où m = k / w²0=
16/ 10,356² = 0,150 kg = 150
g.
- On place une aiguille aimantée au centre d'un
solénoïde d'axe horizontal comprenant 450
spires par mètre. L'axe du solénoïde
est perpendiculaire à la direction nord-sud que
prend l'aiguille aimantée dans le champ
magnétique terrestre. L'aiguille tourne d'un angle
a lorsqu'on fait passer dans
les spires un courant d'intensité I=18mA. La
valeur de la composante horizontale du champ
magnétique terrestre vaut : BH= 2
10-5 T ; m
0 = 4 p
10-7 SI.
- Déterminer la valeur de l'angle a (en degré) dont l'aiguille a tourné.
27 ; 32,2 ; 43,8 ; 63 ; 69,2 ; 74,2. - On considère le circuit ci-dessous
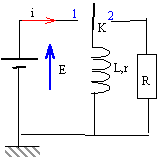
L'interrupteur K est placé en position1 jusqu'à obtention du régime permanent. On bascule ensuite K en position 2. Cet instant est considéré comme instant initial. R= 33 ohms ; E= 12 V ; L= 58 mH ; r= 27 ohms.
- Déterminer la valeur de l'énergie stockée dans la bobine en mJ au bout de 1,4 ms.
17 ; 24 ; 36 ; 45 ; 58 ; 64. - Une bobine d'inductance L et de résistance
r=5,4 ohms est parcourue par un courant dont
l'intensité varie commel'indique la figure.
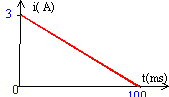
- Déterminer la valeur de L ( mH) pour que la tension aux bornes de la bobine soit nulle à la date t=50 ms.
130 , 180 ; 220 ; 270 ; 330 ; 390. - données : tension aux bornes d'un
moteur U=E' + r'i ; E=6 V ; r = 8 ohms ; R1=
10 W ; R2 = 15
W ; R3 = 17
W ; E'=2 V ; r' = 5
W.
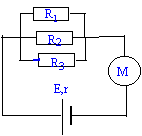
- Calculer la valeur de l'intensité i (mA) du courant délivré par le générateur.
135 ; 229 ; 245 ; 297 ; 349 ; 378. - On considère un générateur de
fem E et de résistance interne r. Il fournit un
courant d'intensité i et la tension à ces
bornes est de 5,4 V. En une heure de fonctionnement ce
générateur fournit au circuit une
énergie de 9,4 kJ. Le rendement électrique
de ce générateur est h=0,85.
- Déterminer la valeur de la fem E ( V) de ce générateur .
5,4 ; 6,4 ; 7,4 ; 8,4 ; 9,4 ; 10,4
corrigé
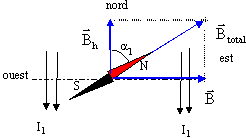
B= m0nI =4p 10-7 *450*18 10-3 = 1,02 10-5 T.
tan a1 = B/Bh = 1,02 10-5 / 2 10-5 = 0,51 et a1 =27°.
t = L/ (R+r) =0,058 / (33+27) = 0,967 ms.
I0 = E/r = 12/27 = 0,444 A
i(t) = I0 e-t/t = 0,444 e -1,4 / 0,967 = 0,104 A
énergie stockée dans la bobine : E = ½Li²
E = 0,5*0,058 * 0,104² = 3,16 10-4 J = 0,316 mJ = 316 mJ.
coefficient directeur de la droite di/dt = - 3/0,1 = -30 A/s ; i(t= 50 ms) = 1,5 A ( lecture graphe)
tension aux bornes de la bobine : u = L di/dt + ri =0
L(-30) + 5,4*1,5 = 0 d'où L= 0,27 H = 270 mH.
les résistors sont en dérivation : les conductances (inverse d'une résistance )s'ajoutent.
G total = 1/ 10 + 1/15 + 1/17 = 0,2255 S soit R équivalent = 1/0,2255 = 4,43W.
intensité I = (E-E') / (Réquivalent + r) = 4/ 17,43 = 229 mA.
rendement h = U/E d'où E = U/h = 5,4 / 0,85 = 6,4 V.
Un mobile
autoporteur S de masse m=452 g est abandoné sans
vitesse initiale sur une table inclinée d'un angle
a
par rapport à l'horizontale. A l'instant choisi comme
origine des dates, son centre d'inertie G se situe en A. On
étudiera le mouvement du centre d'inertie G dans le
reère (A, x, y)Ax horizontal à droite, Ay
vertical vers le bas. Le mouvement de S se fait suivant la
ligne de plus grande pente du plan incliné. Le solide
S est soumis sur la table à une force de frottement
unique, s'opposant au mouvement et d'intensité f
inconnue. Le solide quitte la table en B, il n'est plus
soumis qu'à l'action de la pesanteur. Le point B se
situe à une hauteur h= 90 cm au dessus du sol. On
négligera l'action de l'air sur S. Un dispositif
informatisé permet d'enregistrer les
coordonnées du centre d'inertie sur le plan
incliné.
- Déterminer la valeur de l'angle a (en degré) d'inclinaison de la table.( arrondir à l'entier le plus proche et utiliser cette valeur par la suite).
- Calculer la valeur de la force de frottement s'appliquant sur le mobile.
- La valeur de la vitesse en B est vB=2,69 m/s. Quelle est la longueur de la table en m ?
- Le solide quitte la table avec la vitesse vB précédente. Déterminer les coordonnées du point C de contact avec le sol.
- Calculer la durée du mouvement entre le point A et le point C.
corrigé
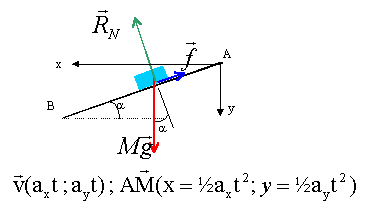
le tableau de mesures permet le calcul de ax et ay :
ax = 2x/t² = 2*1,08 10-2 / 10-2 = 2,16 m/s²
ay = 2y/t² = 2*5,5 10-3 / 10-2 = 1,1 m/s²
accélération a = racine carrée ( ax²+ ay²) = (2,16²+1,1²)½ = 2,42 m/s.
tan a = ay / ax = 1,1 / 2,16 = 0,509 soit a = 27°.
la 2ème loi de Newton projetée sur un axe parallèle au plan incliné, dirigé vers le bas, s'écrit :
-f + mgsin a = ma soit f = m(gsin a- a)= 0,452(9,8 sin27 - 2,42) = 0,92N.
th de l'énergie cinétique entre A et B :
½mv²B-0 = mg AB sina -f AB = AB(mg sina -f )
AB = ½mv²B/ (mg sina -f ) = v²B/(2a) = 2,69² / (2*2,42) = 1,5 m.
chute libre : ( repère d'étude B, x, y)
accélération ( 0, g); vitesse initiale( vB cosa ; vB sina) ; position intiale (0 ; 0)
vitesse, primitive de l'accélération : (vB cosa ; gt+vB sina)
position , primitive dela vitesse : (x= vB cosa t ;y = ½ gt²+vB sina t)
trajectoire : y = ½ g x² / (vB cosa )² + x tana.
y = 4,9 x²/ (2,69 cos 27)² + x tan27 ; y = 0,853 x² + 0,509 x
au sol y = h= 0,9 m
0,9 = 0,853 xC² + 0,509 xC
résoudre : xC = 0,76 m dans le repère (B, x, y)
soit dans le repère (A, x, y) : xC = 0,76 +AB cos a = 2,1 m.
durée du mouvement :
entre A et b : Ab = ½at² soit t² = 2AB/ a = 3,2,42 = 1,24 et t = 1,113 s.
entre B et C : t = xC/(vB cosa ) = 0,76 / (2,69 cos27) = 0,317 s
total : 1,43s.
- L'hélianthine est un indicateur coloré
qui met en jeu un couple acide/base du type
HIn/In- de pKa = 3,8 à 25°C. La
zone de virage de l'hélianthine est [3,1 -
4,5]. La forme acide est rouge, la forme base
conjuguée est jaune. Parmi les affirmations
suivantes combien y en a t-il d'exactes ?
- Une solution aqueuse d'hélianthine de pH=5,8 est jaune.
- L'hélianthine peut être utilisé lors du titrage d'une solution d'acide éthanoïque par une solution d'hydroxyde de sodium.
- L'hélianthine apparaît jaune en présence d'une solution d'acide chlorhydrique obtenue par la mise en solution de 10 mL de chlorure d'hydrogène dans 250 mL d'eau pure ( volume molaire = 24 L/mol)
rappel : HCl + H2O--> H3O+ + Cl-.
- Une solution aqueuse d'hélianthine telle que 3[HIn]=[In-] a un pH de 3,8. - On dispose d'une solution d'acide chlorhydrique
commerciale . Sur l'étiquette on li :
densité = 1,19 ; pourcentage massique en chlorure
d'hydrogène 36% ; masse molaire HCl : 36,5
g/mol.
- Quel volume ( en mL) de la solution commerciale doit-on prélever pour préparer 3L de solution d'acide chlorhydrique à 0,02 mol/L
5 ; 26 ; 65 ; 85 ; 96 ; 112. - On fait réagir 10 mL d'acide sulfurique
sur de la poudre d'aluminium. Il se forme 240 mL de
dihydrogène. Les couples mis en jeu sont :
H+ / H2 et Al3+ / Al. Le volume
molaire vaut : 24 L/mol.
- Déterminer la masse (mg) d'aluminium ayant réagi.
2 ; 30 ; 75 ; 120 ; 158 ; 180. - On réalise le titrage de 20 mL d'une solution
de dioxyde de soufre par une solution de diiode à
0,08 mol/L. Il faut verser un volume de 14,2 mL de diiode
pour obtenir l'équivalence. Les couples mis en jeu
sont : SO42- / SO2 et
I2 / I-. Volume molaire = 24
L/mol.
- Déterminer le volume en mL de dioxyde de soufre que l'on a dissout dans 500 mL d'eau pour obtenir la solution précédente.
148 ; 245 ; 432 ; 542 ; 682 ; 726. - On verse 14,2 g d'acide propanoïque et 8,1 g de
3-méthylpentan-1-ol dans un ballon. On ajoute 2 mL
d'acide sulfurique concentré et quelques grains de
pierre ponce. On effectue un chauffage à reflux
pendant 50 min. On détermine par un titrage
approprié qu'il s'est formé 4,8 g d'ester.
Parmi les propositions suivantes combien y en a-t-il
d'exactes ?
- La pierre ponce permet de réguler l'ébullition lors du chauffage à reflux.
- L'acide sulfurique permet d'augmenter le rendement lors de la synthèse de l'ester.
- L'acide propanoïque a été introduit en excès par rapport à l'alcool.
- La formule semi-développée de l'ester s'écrit : CH3-CH2-CH2-COO -CH2-CH2-CH(CH3)-CH2-CH3.
corrigé
* à pH supérieur à pKa+1 la forme In- prédomine, donc couleur jaune.
* CH3-COOH+HO- -->CH3-COO-+H2O
à l'équivalence du dosage la base conjuguée CH3-COO- est majoritaire, donc le pHéqui est supérieur à 7.
Or la zone de virage de l'indicateur coloré doit contenir le pHéqui.
*0,01 / 24 = 4,16 10-4 mol HCl ; [H3O+]=4,16 10-4 /0,25 = 1,66 10-3 mol/L
pH = -log1,66 10-3 = 2,78. donc l'hélianthine est rouge.
*pH= pKa + log([In-]/[InH])
log([In-]/[InH]) = pH-pKa = -0,7 et [In-]/[InH] = 10-0,7 = 0,2 ; [InH] / [In-] = 5.
* à pH = pKa alors [In-]=[InH]
1190 *0,36 / 36,5 = 11,74 mol/L pour la solution du commerce.
Qté de matière : 3*0,02 = 0,06 mol
0,06 = 11,74 V soit V = 5,1 10-3 L = 5,1 mL.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
masse d'aluminium : 6,67 10-3 *27 = 0,18 g = 180 mg.
SO2 + 2H2O=SO42- + 4H+ + 2e- oxydation
I2 + 2e- = 2I- réduction
SO2 + 2H2O + I2 = SO42- +4H+ + 2I- oxydo-réduction
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= 1,136 10-3 mol |
soit 2,84 10-2 mol dans 500 mL
volume de gaz SO2 dissous : 2,84 10-2* volume molaire = 2,84 10-2 *24 = 0,682 L=682 mL.
* la pierre ponce régularise l'ébullition
* l'acide sulfurique est un catalyseur : il augmente à la fois la vitesse d'estérification et celle d'hydrolyse de l'ester. Le catalyseur n'augmente pas le rendement, on atteint plus rapidement l'équilibre.
* masse molaire : acide propanoïque CH3-CH2-COOH : 74 g/mol
alcool : CH3-CH2-CH(CH3)-CH2-CH2OH ( C6H14O) : 102 g/mol
ester CH3-CH2-COO-CH2-CH2-CH(CH3)-CH2-CH3 : 158 g/mol
Qté de matière : acide :14,2/74 = 0,192 mol
alcool : 8,1 / 102 =0,08 mol ( en défaut) donc x max = 0,08 mol
ester : 0,08 * 158 = 12,64 g valeur théorique
rendement h = 4,8 / 12,64 = 0,38 (38%)
Une pile d'oxydo-réduction est constituée
en associant les deux demi-piles suivantes :
- Une lame de zinc de 7,34 g trempant dans 100 mL d'une
solution de sulfate de zinc à 0,1 mol/L.
- Une lame d'aluminium de 4,37 g trempant dans 100 mL d'une solution de sulfate d'aluminium à 0,1 mol/L
Les deux demi-piles sont reliées par un pont salin contenant une solution gélifiée de chlorure de potassium. La pile débite un courant d'intensité I pendant 3 heures. On constate alors que la masse de l'électrode de zinc a diminué de 1,6 %.
N=6,02 1023 mol-1 ; e= 1,6 10-19 C; Zn = 65,4 ; Al = 27 g/mol.
- Indiquer le schéma conventionnel de cette pile.
- Déterminer la valeur (mA) du courant débité par cette pile.
- Calculer les concentrations molaires ( mmol/L) des ions Al3+ et Zn2+.
corrigé
le zinc s'oxyde et libère des électrons : le zinc constitue la borne négative.
Zn --> Zn2+ + 2e- anode négative.
Al3+ + 3e- --> Al réduction donc cathode
schéma conventionnel : - Zn / Zn2+ / / Al3+ / Al +.
|
|
|
|
|
|
|
|
= 0,1122 mol |
|
|
|
|
|
|
|
|
|
|
|
donc 3 x = 1,8 10-3 mol x = 6 10-4 mol |
= 1,88 10-2 mol |
= 1,18 10-2 mol |
à t = 3h, la masse de zinc diminue de 7,34 *1,6/100 = 0,11744 g soit 0,11744 / 65,4 = 1,8 10-3 mol
[ Al3+] = 1,88 10-2 / 0,1 = 0,188 mol/L.
[Zn2+]=1,18 10-2 /0,1 = 0,118 mol/L.
Qté de matière d'électrons = 2* Qté de matière de zinc ayant disparu) (Zn --> Zn2+ + 2e- )
2*1,8 10-3 = 3,6 10-3 mol d'électrons.
Qté d'électricité : Q= 96500 * 3,6 10-3= 347,4 coulombs
or Q(C) =I (A) t (s) d'où I = Q/t = 347,4 / (3*3600) = 0,032A = 32 mA.
Dans un ballon on traite à chaud pendant deux heures, une masse m= 4g d'un triglycéride par un volume vB= 60 mL d'une solution de soude ( hydroxyde de sodium) de concentration cB=1 mol/L. On considére cette réaction comme totale.
R-COO-CH2 - CH(OOC-R)- CH2-OOC-R (triglycéride)+ 3(Na+ + HO-) -->3(R-COO- + Na+)
+ CH2OH-CH(OH)-CH2OH ( glycérol).
On refroidit l'ensemble et on procède au titrage de la quantité d'hydroxyde de sodium restante dans le ballon. Il faut verser un volume vA= 40,5 mL d'une solution d'acide chlorhydrique de concentration cA= 0,5 mol/L pour obtenir l'équivalence.
- Déterminer la masse molaire du triglycéride.
- Ce triglycéride est un triester du glycérol et d'un acide carboxylique saturé. Donner la formule brute de cet acide carboxylique.
- En réalité la réaction de saponification se fait avec un rendement de 85%. Calculer la masse (en kg) de glycérol obtenu lors de la saponification de 1,4 tonnes de ce triglycéride. C=12 ; O=16 ; H=1 g/mol.
corrigé
Qté de matière de soude:
initiale : 0,06 mol
restante : 0,5 * 40,5 10-3 = 0,02 mol
donc 0,06-0,02 = 0,04 mol de soude a réagi avec0,04 / 3 = 0,01325 mol de triglycéride
M, masse molaire du triglycéride : 0,01325 = 4 /M soit M = 4/0,01325 = 302 g/mol.
R-COO-CH2 - CH(OOC-R)- CH2-OOC-R s'écrit : C6H5O6R3.
302 = 6*12 +5 +6*16 +3X d'où X= 43 g/mol
R est identifié à C3H7. La formule brute de l'acide est C4H8O2.
acide butanoïque CH3-CH2-CH2-COOH
autre possibilité : acide 2-méthylpropanoïque : (CH3)2CH-COOH
masse molaire : glycérol : 92 g/mol ; triglycéride : C15 H26 O6 : 302 g/mol
Qté de matière de triglycéride : 1,4 106 / 302 = 4,63 103 mol
donc 4,63 103 mol glycérol ( si rendement de 100%)
soit en masse : 4,63 103 *92 = 4,27 105 g = 0,427 tonne.
en tenant compte du rendement : 0,427*0,85 = 0,36 tonne.