durée 1 h 30
tronc commun +
une option au choix parmi trois options
proposées
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
alcool + chlorure d'acyle |
 |
|
|
|
soude , KOH , potasse : base |
|
|
|
|
|
|
|
méthanol, éthanol, CH3-CH2-CHOH-CH3, CH3COOH |
|
|
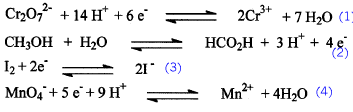
H3O+ et HO- constituent un couple acide base ? Kb est l'inverse de Ka ? CO32- est la base conjuguée de HCO3- ? |
Ka Kb = 10-14 à 25°C CO32- est la base conjuguée de HCO3- exact |
|
|
(2) et (4) fausses, non conservation de la charge. en (2) écrire 4H+ ; en (4) écrire 8H+ ; |
|
S1 : [H3O+]= 2 10-3 mol/L S2 :[HO-]= 10-9 mol/L S3 : pH=4,5 S4 : 1,25 L de cette solution renferme 3 10-4 mol H3O+ |
S1 : pH = 2,7 S2 : [H3O+]= 10-14 / 10-9 = 10-5 et pH=5 à 25°C S4 :[H3O+]=3 10-4 /1,25 = 2,4 10-4 mol/L et pH = 3,7 |
|
Quelle est sa formule brute ? |
formule brute CxHyOz 12 x/0,72 = y / 0,067 = 16z / 0,213 = 150 d'où x = 9 ; y= 10 ; z= 2 C9H10O2. |
|
RMN du proton : 4,12 ppm, intégration 1H 3,10 ppm intégration 2H ; 0,95 ppm intégration 9H Quelle est sa formule ? |
0,95 ppm intégration 9H : 3 méthyl (CH3)3- 3,10 ppm intégration 2H : CH2 déblindé par O : O-CH2- (CH3)3C-CH2-OH |
|
en les jetant dans l'eau en les jetant dans l'alcool éthylique en les faisant brûler |
|
|
ajoute t-on l'eau à l'acide concentré ajoute t-on l'acide concentré dans l'eau ajoute t-on simultanément l'acide concentré et l'eau. |
|
|
|
|
|
2- La cathode est l'électrode où se produit l'oxydation. 3- Une pile est constituée par les deux
demi piles suivantes : lame d'argent dans une solution à 0,1 mol/L nitrate d'argent * Quelle est la valeur du potentiel de l'électrode de plomb ? 0,82 V ; -0,156 V ; 0,185 V ; -0,59 V * Quelle est la valeur du potentiel de l'électrode d'argent ? 1,72 V ; -3 V ; 0,73 V ; -0,8 V * Quelle est la f.e.m de la pile ? E(Pb2+/Pb)= -0,126 V ; E(Ag+/Ag)=0,79 V |
2- faux cathode = réduction 3. E (Pb2+/Pb) = -0,126 +0,06/2 ln 0,1= -0,156 V E (Ag+/Ag) = 0,79 +0,06 ln 0,1= 0,73 V f.e.m = 0,73 - (-0,156) = 0,886 V |
|
|
|
|
|
K=[Ag+]²[CrO42-] ; s= [CrO42-] K= (2s)²*s = 4 s3 = 2,3 10-10 ; s = 3,86 10-4 mol/L |
|
|
|
|
couples : eau / méthanol ; eau/ chloroforme ; hec=xane/ éther éthylique |
|
|
* un déplacement chimique vers des champs plus faibles correspond à .... et à .... * Le déplacement chimique est de 200 Hz par rapport au TMS et la fréquence du spectrophotomètre est 60 MHz, quel est le déplacement en ppm ? * Un proton a un déplacement chimique de 2,5 ppm à 200 MHz. Quel est son déplacement à 400 MHz ? |
une valeur croissante en ppm 200/60 = 3,33 ppm 2,5 ppm Le déplacement en Hz est proportionnel à la fréquence, mais exprimé en ppm il est indépendant de la fréquence |
|
1 angström ; micron ; nanomètre ; picomètre |
|
|
|
A nombre de nucléons : protons et neutrons |
|
|
1 : substance toxique 2 : substance comburante 3 : substance corrosive 4 : substance dangereuse pour l'environnement 5 : substance explosive 6 : substance inflammable ; 7 : substance nocive. |
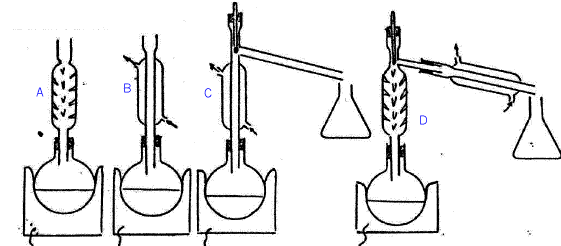
chauffage à reflux : A ; distillation : C ; distillation fractionnée : D
nom des composés ci-dessous :
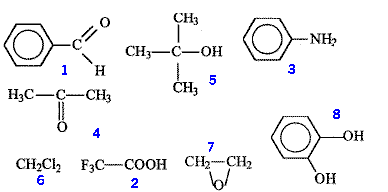
1 : benzaldehyde ; 2 : acide trifluoroéthanoïque ; 3 : aniline ; 4 : acétone; 5 : 2-méthylpropan-2-ol
6 : dichlorométhane ; 7 oxyde d'éthylène ; 8 : orthodiphénol
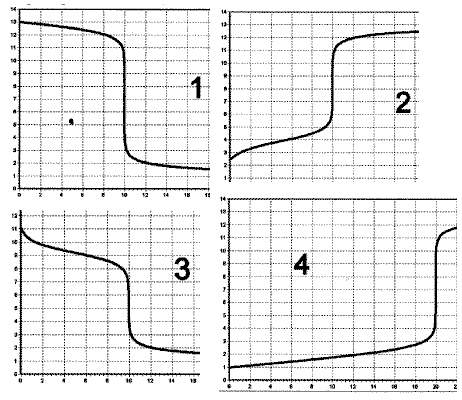
On réalise 4 dosages ( graphes ci-dessus)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
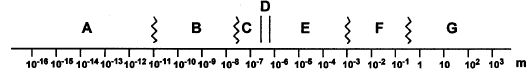
attribuer un nom à chaque domaine .
A : ondes radio; B :micro-ondes; C : IR ; D : visible ; E : UV ; F : rayon X ; F : rayon g.
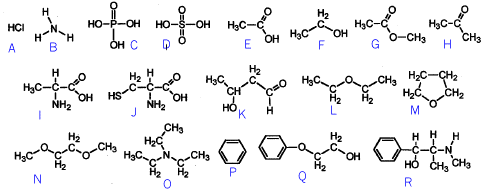
Quelles sont les molécules qui correspondent à :
1- des amines ; 2- des aldehydes ; 3- des ethers ; 4- esters; 5- acides ; 6 - alcools.
amines : B, I , J , O ; R.; alcool: F, K, Q, R
aldehydes : K ; ether : L, M, N ; ester : G ; acides : A, C, E, I, J,
Parmi les formules précédentes retrouver celles de l'ammoniaque, acide acétique, benzène, tétrahydrofuranne, éthanol, triéthylamine:
B: ammoniaque ; E : acide
acétique ; P: benzène ; M:
tétrahydrofuranne ; F: éthanol ; O:
triéthylamine.
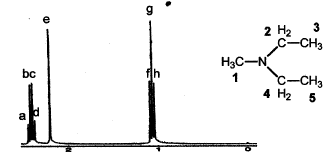
Dans ce spectre RMN attribué à chaque groupe hydrocarboné le ou les signaux correspondants.
singulet e : protons du groupe CH3 lié à l'azote
triplet fgh : 6 protons des méthyles couplés avec les groupes CH2-
quadruplet abcd : groupes
N-CH2-
La 1,1-diméthylhydrazine
est un liquide de masse molaire 60 g/mol, ayant une
densité de 0,8 . Le 4-hydrobenzaldehyde est un solide
de masse molaire 122 g/mol. Une réaction de
condensation a lieu estre ces deux réactifs. Quelle
est la masse molaire de leur produit de réaction
?
condensation avec
élimination d'eau : donc 122+60-18 = 164 g/mol
Le rendement de la
réaction précédente est de 67% en
produit isolé. Si on veut obtenir 11 g de produit
final, combien de 1,1-diméthylhydrazine faut-il
utiliser ?
11 / 164 = 0,067 mol produit final
en conséquence 0,067 / 0,67 = 0,1 mol 1,1-diméthylhydrazine
0,1*60 = 6g ; 6 / 0,8 = 7,5 mL.
- Isotopes du carbone :
On considère les rapports isotopiques du carbone : 14C / 12C = 1,21 10-14 ; 13C / 12C = 1,12 10-2 ;
- Quels sont les isotopes stables du carbone ?
- Quel est le pourcentage de chaque isotope par rapport au carbone total ?
- On considère 100 mL de CO2 à la pression de 1 bar et à la température de 25°C. Calculer le nombre de moles de 14CO2 , 13CO2 et de 12CO2 . En déduire le nombre d'atome de 14C , 13C , 12C et O présents dans ces 100 mL de CO2.
R= 8,31 J mol-1 K-1; N= 6,022 1023 mol-1; 1 bar = 1,013 105 Pa.12C et 13 C sont stables
x+y+z=100 soit x + 1,12 10-2 x +1,21 10-14 x =100
x = 98,8924 % ; y= 1,1076 %; z = 1,2 10-12 %.
volume molaire Vm = RT/P
= 8,31*298/1,013 105 = 24,45 L/mol
n= 0,1/24,45 = 4,09 10-3 mol
12C : 4,09
10-3 *0,9889 = 4,0446 10-3 mol
13C : 4,53 10-5 mol ; 14C :
4,9 10-17 mol ;
puis pour obtenir le nombre
d'atomes, multiplier les résultats
précédents par le nombre d'Avogadro
- Dosage du diiode :
On dispose de pentahydrate de thiosulfate de sodium cristallisé Na2S2O3, 5H2O et du matériel de verrerie nécessaire suivant : éprouvette de 100 mL, fiole jaugée de 250 mL, burette graduée de 50 mL, erlenmeyer de 100 mL.
- Indiquer comment préparer une solution aqueuse de thiosulfate de sodium de concentration c= 0,2 mol/L. Préciser le nom de la verrerie utilisée.
Etablir l'équation bilan de la réaction de dosage.
- Indiquer le mode opératoire à suivre pour réaliser le dosage. Comment détermine-t-on le point d'équivalence ?
masse molaire en g/mol : Na= 23 ; O=16 ; H=1 ; S=32
potentiel standart : E(I2/I-)=0,54 V et E(S2O32-/S4O62-)=0,08V.
2S2O32- + I2 = S4O62- +2 I- .
fiole jaugée de 250 mL : qté de matière de thiosulfate de sodium : 0,2*0,25 = 0,05 mol
masse molaire thiosulfate de sodium : 23*2+32*2+3*16+5*18= 248 g/mol
masse de solide à peser à l'aide d'une balance de précision : 0,05*248 = 12,4 g
dissoudre dans l'eau distillée puis compléter la fiole jaugée ( eau distillée) jusqu'au trait de jauge.
dans la burette : diiode ; dans un erlenmeyer : 20 mL solution thiosulfate+ empois d'amidon
après l'équivalence : en présence d'empois d'amidon le diiode en excès donne une coloration violette foncée.