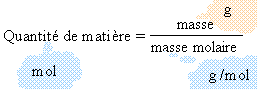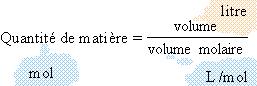|
degré d'avancement d'une réaction (ac. Lille) Combustion du magnésium En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
données: volume molaire= 24 L mol-1 O=16 ; Mg=24,3 ; Cl=35,5 ; Ti = 47,9 g /mol. I Combustion du magnésium Dans un flacon à combustion on fait brûler un ruban de magnésium de masse m= 486 mg avec un volume V = 12 L de dioxygène.
corrigé |
||||||||||||||||||||
|
486 mg = 0,486 g ; puis 0,486 / 24,3 = 0,02 mol. quantité de matière de dioxygène (gaz).
12 / 24 = 0,5 mol
tableau d'avancement:
soit 0,02-2 xmax=0 --> xmax =0,01 mol soit 0,5 -xmax=0 --> xmax =0,5 mol le magnésium est en défaut, le dioxygène en excès volume de dioxygène restant : quantité de matière (mol) fois volume molaire (L/mol) 0,49*24 =11,76 L. masse de magnésie (g) = masse molaire (g/mol) fois quantité de matière (mol) (24,3+16) * 0,02 = 0,806 g.
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
II Métallurgie du titane Le titane est un métal léger, ce qui le rend très utile en aéronautique sous forme d'alliages. Il est également très utilisé en constructions navales, on le rencontre également dans d'autres domaines très variés : construction de pièces d'usines, prothèses médicales...etc. La transformation chimique suivante est une des principales étapes de sa fabrication industrielle .
corrigé quantité de matière:
masse molaire du tétrachlorure de titane :47,9 +4*35,5=189,9 g/mol 570/189,9 = 3 mol. puis : 243 / 24,3 = 10 mol de magnésium. tableau d'avancement:
soit 3- xmax=0 --> xmax =3 mol soit 10 -2xmax=0 --> xmax =5 mol le magnésium est en excès, le tétrachlorure de titane en défaut masse de magnésium restant : quantité de matière (mol) fois masse molaire (g/mol) 4*24,3 =97,2 g. masse de titane (g) = masse molaire (g/mol) fois quantité de matière (mol) 47,9* 3 = 143,7 g. |
|||||||||||||||||||||
| |
|||||||||||||||||||||
|