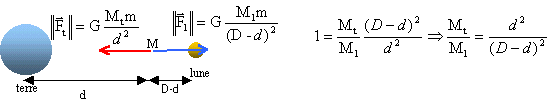|
composition %, concentration, diution En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
il existe sur une ligne joignant les centres des astres lune et terre ( on nommera L le centre de la lune et T le centre de la terre) un point M tel que les forces de gravitation exercées sur tout objet placé en M se compensent. Masse de la terre / masse de la lune = 81; distance terre lune D= 4 105 km.
corrigé |
|||||
|
La masse de la terre est notée Mt et celle de la lune est notée Ml.
prendre la racine carrée de chaque membre de l'égalité ci-dessus. racine carrée (81) = 9 = d / (D-d) produit en croix : 9D-9d = d d = 0,9 D = 0,9*4 105 = 3,6 105 km. échelle conseillée : prendre 10 cm pour 4 105 km le point M est à 9 cm du centre de la terre, à 1 cm du centre de la lune
|
||||||
|
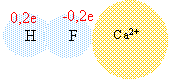
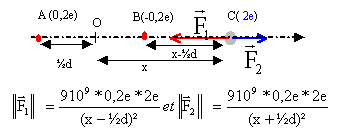
La molécule HF est un exemple de molecule polaire. Dans cette molécule, le barycentre A des charges positives (charge ponctuelle0,2 fois la charge élémentaire e) n'est pas confondu avec le barycentre B des charges négatives(charge ponctuelle-0,2e). Ces deux barycentres sont équidistants de 3,8.10-12 mètre. On envisage une situation où A et B sont sur un axe Ox orienté positivement vers la droite respectivement aux abscisses +½d et -½d.
les deux vecteurs ayant même direction, le sens contraire, la norme du vecteur somme vectorielle peut s'écrire en mettant 9 109 *0,4e2 = 3,6 e2 109 en facteur commun : 3,6 e2 109 [1 / (x-½d)² - 1 / (x+½d)² ] si x est très grand devand d alors cette valeur est voisine de : 3,6 e2 109 *2d / x3 = 7,2 e2 109 *d / x3 . d= 3,8 10-12 m et x= 10-9 m soit x3 = 10-27 m3. 7,2 * (1,6 10-19)2 *109 * 3,8 10-12 / 10-27 = 7 10-13 N.
|
||||||
|
composition : sur l'étiquette d'un flacon on peut lire : gluconate de cuivre 22,50 mg soit 3,15 mg de cuivre; formule brute C12H22O14Cu gluconate d'argent 3,00 mg soit 1,068 mg d'argent; formule bruteC6H11O7Ag eau purifiée: quantité supplémentaire pour atteindre 100mL flacon 100mL
masse atomique molaire en g/mol : H=1 ; C=12 ; O=16 ; Cu=63,5. corrigé Les métaux à l'état solide sont insolubles en solution. pourcentage massique de cuivre : - à partir des indications de l'étiquette : 3,15*100 / 22,5 = 14%. - à partir des masses molaires : masse molaire gluconate de cuivre : 12*12+22+16*14+63,5 = 453,5 g/mol masse atomique du cuivre : 63,5 g/mol 63,5*100 / 453,5 = 14%. C12H22O14Cu (solide) --> Cu2+ + 2 C6H11O7-. Quantité de matière de gluconate de cuivre : 22,5 mg = 0,0225 g masse (g) / masse molaire (g/mol) = 0,0225 / 453,5 = 4,96 10-5 mol diviser par le volume de la solution en L concentration
gluconate de cuivre = [Cu2+]=4,96 10-5 / 0,1 = 4,96 10-4
mol/L.
volume fiole jaugée / volume pipette graduée = 5 donc prélevé 20 mL de la solution mère à la pipette graduée + pipeteur placer dans une fiole jaugée de 100 mL compléter avec de l'eau distillée.
|
||||||
|