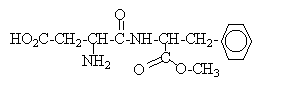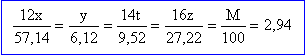|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
L'aspartame est un édulcorant synthétisé en 1965. Il comprend des atomes de carbone, d'hydrogène, d'oxygène et d'azote. La combustion complète de 0,01 mol d'aspartame donne 1,62 g d'eau. La composition massique de l'aspartame est : C = 57,14 % ; O= 27,22 %; N = 9,52 % ; H = 6,12 %.
masse atomique molaire (g/mol) : C=12 ; H=1 ; O=16 ; N=14.
corrigé
|
|||||
|
substance qui donne le goût sucré sans avoir les inconvénients du saccharose sur l'organisme . Quantité de matière d'eau (mol) = masse (g) / masse molaire (g/mol) 1,62 / 18 = 0,09 mol d'eau 0,09 mol d'eau issue de 0,01 mol d'aspartame l'élément hydrogène représente 0,09*2 = 0,18 g dans 0,01 M g d'aspartame soit en pourcentage massique : 0,18 / (0,01 M) = 6,12 M : masse molaire de l'aspartame soit M= 294 g/mol . formule brute de l'aspartame : Cx Hy Oz N t avec x, y z t entiers
y = 2,94 * 6,12 = 18 x = 2,94*57,14 / 12 = 14 t = 2,94*9,52/ 14 = 2 z = 2,94*27,22 / 16 = 5 C14 H18 O5 N2 .
|
||||||
|