| |
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||
| |
|
|||||||||||
|
|
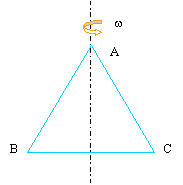
triangle en rotation |
|
||||||||||
| |
vitesse angulaire (rad/s) = 2 p fréquence (Hz) w = 6,28*100 = 628 rad s-1. Tous les points d'un solide indéformable ont la même vitesse de rotation; mais leur vitesse linéaire dépend de leur distance à l'axe de rotation. le point A étant sur l'axe sa vitesse linèaire est nulle Les points B et C sont distants de 0,4 m de l'axe. Leur vitesse de rotation est : 628 *0,4 = 251,2 ms-1.
|
|||||||||||
|
freinage d'un véhicule se déplaçant en ligne droite |
corrigé |
|||||||||||
| |
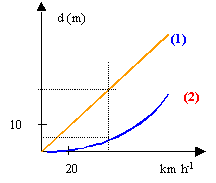
(1) est linéaire : vitesse et distance d1 sont proportionnelles. Le rapport distance sur vitesse est homogène à un temps: durée mise par le conducteur pour réagir. (voisin de 2 s) Pour une vitesse de 45 km /h la distance d1 vaut 3*8,25 = 24,75 m.
Dans la phase 2 le mouvement est uniformément freiné. Pour une vitesse de 45 km/h le graphe indique d2 voisin de 5 m distance de réaction et d'arrêt égales : point d'intersection des 2 graphes ou bien résoudre le système d/ v² =0,05 et d/v=2 on trouve 40m/s ou 144 km/h
|
|||||||||||
|
vitesse angulaire d'un disque CD |
Le lecteur optique d'un lecteur de CD ROM se trouve Ro = 5,43 cm du centre du disque. Sa vitesse doit être de Vo = 1,25 m.s -1 pour que la lecture soit correcte. Le moteur est alors alimenté par Io = 0,1 A sous une tension de Uo = 5 V.
|
|||||||||||
| |
vitesse linéaire (m/s) = vitesse angulaire (rad/s) fois distance (m) si la vitesse linéaire reste constante, la vitesse angulaire augmente quand on se rapproche du centre . w = 1,25/0,0543 = 23 rad s-1. pour la distance de 0,022 m w = 1,25/0,022 = 56,8 rad s-1. w = k * I avec k constante V0= w0 R0= kI0 R0 d'où k= V0/ (I0 R0) w = k * I= V0I / (I0 R0) calcul de la résistance interne r : U0= 1,2 + r I0. 5 = 1,2 + r *0,1 d'où r= 38 ohms calcul de l'intensité I : 23 = k I0 = k*0,1 56,8 = k I d'où I= 0,25 A calcul de U: U = 1,2 + 38*0,25 =10,7 V 150 000 octets à chaque seconde distance parcourue en 1 s = 1,25 m 1,25 / 150 000 = 8,3 microns
|
|||||||||||
|
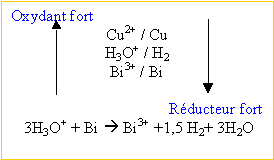
le couple bismuth Bi3+ / Bi |
|
|||||||||||
| |
|
|||||||||||
| |
|
|||||||||||
|
composition d'un alliage |
Le laiton est un alliage de cuivre et de zinc Afin d'étudier son pourcentage en masse de zinc, on attaque 3 g d'alliage par de l'acide chlorhydrique en excès. On recueille 183 mL de gaz.
|
|||||||||||
| |
0,183 /24 = 7,62 mmol de dihydrogène donc 7,62 mmol de zinc soit 7,62*65,4 = 0,5 g 0,5 g de zinc dans 3 g d'alliage 0,5*100/3 = 16,6 % le filtrat contient de l'acide en excès et des ions zinc Zn2+. La soude va réagir avec l'acide pour donner du chlorure de sodium les ions zinc peuvent réagir avec la soude pour donner de l'hydroxyde de zinc , solide blanc Zn(OH)2.
|
|||||||||||
|
couples redox |
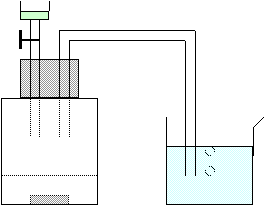
Le liquide A est de l'acide chlorhydrique en grand excès. Le liquide C est du sulfate de cuivre (II). La lame B est du fer solide.
corrigé |
|||||||||||
| |
Fe+ 2 H3O+ --> Fe2+ + H2 + 2 H2O Le bécher contient le sulfate de cuivre. Les ion cuivre sont réduits par le dihydrogène qui se dégage. Cu2+ + H2 --> Cu + 2H+. Tous les ions cuivre Cu2+ ont disparu à la fin des réactions (pas de solide bleu lors de l'ajout de soude). fer et acide chlorhydrique sont en excès et le sulfate de cuivre est en défaut.
|
|||||||||||
|
|
|