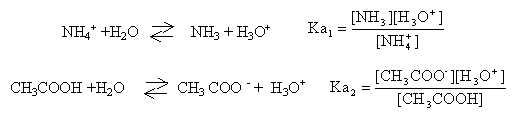|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
|
||||||
|
|
On considère les trois solutions suivantes : - Solution 2 : 100mL d'une solution d'acétate d'ammonium à 0,10 mol/L - Solution 3 : 50mL d'une solution de chlorure d'ammonium à 0,20mol/L et 50mL d'une solution d'acétate de sodium à 0,20mol/L
NH4+ / NH3 pKa1 = 9,2 ; CH3COOH / CH3COO- pKa2 = 4,8.
corrigé |
|||||
|
NH3 + CH3COOH donne NH4+ + CH3COO-. ammoniac et acide acétique : réaction acide base (avec arrêt à l'équivalence) Qté de matière initiale des réactifs : ammoniac : 50*0,2 = 10 mmol acide éthanoïque : 50*0,2 = 10 mmol les réactifs sont en quantités stoéchiomètriques : il se forme 10 mmol d'ion éthanoate et d'ion ammonium dans 100 mL de solution d'où : [NH4+]=[CH3COO-] =0,1 mol/L. donc la solution 2 est identique à la solution 1.
50 mL d'une solution de chlorure d'ammonium à 0,20 mol/L et 50 mL d'une solution d'acétate de sodium à 0,20 mol/L pas de réaction chimique entre les ions présents présents. le volume final de la solution est 100 ml soit 0,1L. La réaction entre l'eau et les ions éthanoate et ammonium est très limitée, de plus les ions Na+ et Cl- sont spectateurs. donc [NH4+] = [CH3COO-] = 0,05*0,2 / 0,1 = 0,1 mol/L. ion chlorure et ion sodium spectateurs de concentration égale à 0,1 mol/L le calcul du pH de la solution 3 est
identique à celui de la solution 2.
espèces présentes en solution : NH4+ ; NH3 ; CH3COO- ; CH3COOH ; H2O ; HO- et H3O+. conservation élément carbone : [CH3COO-] +[CH3COOH] = 0,1 mol/L (1) la réaction des ions CH3COO- avec l'eau est trés limitée. donc [CH3COO-] voisin 0,1 mol/L conservation élément azote : [NH3]+[NH4+ ]= 0,1 mol/L (2) la réaction des ions NH4+ avec l'eau est trés limitée. donc [NH4+] voisin 0,1 mol/L [NH4+] = [CH3COO-] =0,1 mol/L (3) (1) et (2) donnent : [CH3COO-] +[CH3COOH] = [NH3]+[NH4+ ] compte tenu de (3) il vient : [CH3COOH] = [NH3] constante d'acidité :
faire le produit des pKa simplifier en tenant compte des résultats ci-dessus Ka1 Ka2 = [H3O+]² prendre le logarithme log Ka1 + logKa2 = 2 log [H3O+] -log Ka1 - logKa2 = -2 log [H3O+] soit pH = ½(pKa1+pKa2)=0,5(9,2+4,8) = 7.
|
||||||
|