|
centres étrangers I - juin 01 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||||
|
|||||||||||||||
|
|
Isoméries : Considérons les composés dont les formules semi-développées sont les suivantes : CH3-CHOH-CH2-CH3 butan-2-ol ; C6H5-CH2-O-CO-CH3 éthanoate de benzyle ; CH3-CH=CH-CH2-CH3 pent-2-ène ; CH3-CH=CH2 propène
Synthèse de l'acétate de benzyle : On utilise le montage à reflux :
le ballon contient 10 g d'acide éthanoïque (acétique) avec de l'alcool
benzylique liquide en présence d'acide sulfurique. On ajoute quelques
grains de pierre ponce et on chauffe 30 min.
masse molaire (g/mol)
|
||||||||||||||
|
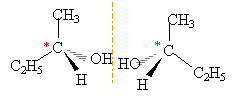
la présence d'un carbone asymètrique entraîne l'existence de deux isomères optiques (énantiomères), symétriques l'un de l'autre dans un miroir.
le pent-2-ène présente l'isomérie (Z-E) : il existe deux diastéréoisomères
le butan-1-ol, alcool primaire est un isomère de position du butan-2-ol, alcool secondaire CH3-CH2-CH2-CH2OH
il s'agit d'un estérification, lente, athermique limitée par l'hydrolyse de l'ester. acide éthanoïque + alcool benzylique = éthanoate de benzyle + eau CH3-CO2H + C6H5-CH2OH
équilibre avec C6H5-CH2-O-CO-CH3
+ H2O
donc 0,1667 mol alcool benzylique soit 0,1667 / 108 = 18g ou encore 18 / 1,04 = 17,3 mL.
masse réelle d'ester / masse théorique calculée * 100 ou encore volume réel d'ester / volume théorique calculé * 100 à partir de 0,1667 mol d'acide éthanoïque on peut en théorie obtenir 0,1667 mol d'ester soit 0,1667 * 150 = 25g ou encore 25 / 1,06 = 23,6 mL d'ester rendement 15,8 / 23,6 *100 = 67%. valeur attendue au départ d'un
mélange équimolaire d'acide et d'alcool primaire.
l'acide sulfurique catalyse l'esterification et l'hydrolyse : l'équilibre sera plus rapidement atteint mais non modifié. en remplaçant l'acide éthanoïque par la même quantité d'anhydride éthanoïque, la réaction est totale.
|
|||||||||||||||
|