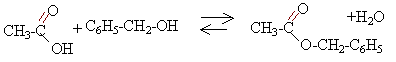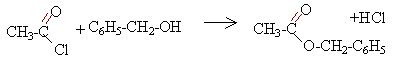|
Liban 06/01 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|
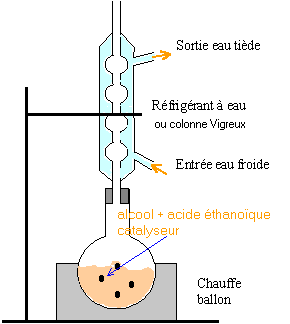
préparation d'un ester : éthanoate de benzyle présent dans un extrait de jasmin
Le matériel sera choisi parmi les éléments suivants : ballon à fond rond, réfrigérant à boules, chauffe ballon, colonne de Vigreux, agitateur magnétique, ampoule à décanter, réfrigérant droit à eau, thermomètre. réaction entre l'acide éthanoïque et l'alcool benzylique : L'acide sulfurique joue le rôle de catalyseur. On dispose d'une solution saturée de chlorure de sodium. On chauffe à reflux.
amélioration du rendement : On désire augmenter le rendement de cette synthèse en utilisant deux méthodes différentes.
accélére la réaction ( en travaillant à température plus élevée) et évite les pertes de matière
équation bilan de la réaction : alcool benzylique + acide éthanoïque équilibre avec éthanoate de benzyle + eau
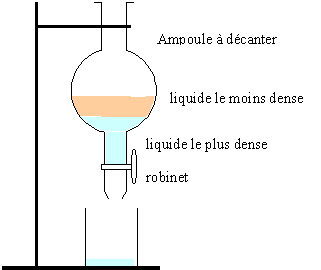
séparation à froid de l'ester : ajouter au contenu du ballon de l'au saturée en chlorure de sodium, afin de rendre quasi nulle la solubilité de l'ester dans l'eau. placer le tout dans une ampoule à décanter: les réactifs ( en excès) et le catalyseur sont dans l'eau et l'ester se retouve seul (liquide non miscible à l'eau).
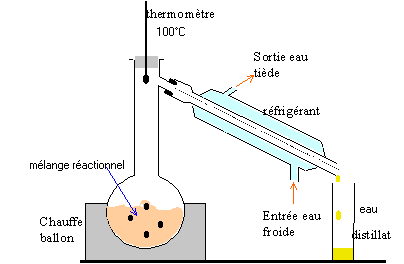
rendement : masse réelle d'ester obtenue / masse théorique d'ester *100 % Quel est le réactif en excès ? 133,7 * 1,05 = 140,4 g d'alcool 140,4 / 108 = 1,3 mol alcool benzylique 74,3 * 1,05 = 78 g 78 / 60 = 1,3 mol acide éthanoïque les quantités de réactifs sont stoéchiométriques. On peut théoriquement obtenir 1,3 mol d'ester soit : 1,3 * 150 = 195 g rendement : 113,1 / 195 *100 = 58 %. loi de modération (Le Chatelier) : en conservant les mêmes réactifs en même quantité on peut déplacer l'équilibre vers la formation de l'ester en éliminant l'un des produits (le plus volatil, ici l'eau) au fur et à mesure qu'il se forme. montage de distillation :
En utilisant le chlorure d'éthanoyle ou l'anhydride éthanoïque à la place de l'acide éthanoïque, on obtient un rendement proche de 100%.
avantage : rendement élevé inconvénients : chlorure ou anhydride plus couteux que l'acide éthanoïque réaction rapide exothermique, dégagement de chlorure d'hydrogène ( donc travail sous hotte et refroidir le mélange réactionnel au bain de glace)
|
||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||
|