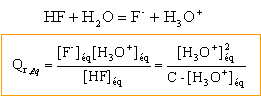|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
On mesure la conductivité de différentes solutions d'acide fluorhydrique HF :
conductivité molaire ionique en Sm²/mol : l H3O+ =3,5 10-2 ; l F- = 5,54 10-3.
La concentration des ion fluorure est égale à la concentration des ions oxonium : [F- ] =[H3O+] les ions oxonium et fluorure contribuent à la conductivité de la solution : s = (l H3O+ +l F- ) [H3O+]= ( 3,5 +0,554) 10-2 [H3O+] soit [H3O+] = s /4,05 10-2 = 24,67 s . [H3O+] s'exprime en mol m-3 ; xf = [H3O+] 10-3 = 24,67 10-3 s mol.
les concentrations s'expriment en mol/L dans ce calcul.
d'après la dernière ligne du tableau, le coefficient de réaction dans l'état d'équilibre est constant, indépendant de la concentration initiale : ce coefficient représente la constante d'équilibre K associée à la réaction ci-dessus.
recherche de l'avancement maximal :
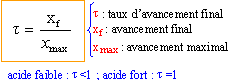
pour 1 L de solution :
le taux d'avancement final augmente lorsque la concentration en acide fluorhydrique diminue. règle de Le Chatelier ou règle de modération: en ajoutant de l'eau (un réactif) on déplace l'équilibre dans le sens "comsommation de l'eau", c'est à dire dissociation de l'acide faible en ion oxonium et fluorure. par dilution, un acide faible se rapproche du comportement d'un acide fort.(t tend vers 1). |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|