|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Etude de la cinétique entre l'acide oxalique H2C2O4 et l'ion permanganate MnO4- suivie par spectrophotométrie. La réaction s'effectue dans la cellule d'analyse du spectrophotomètre. Réglage du spectrophotomètre : Afin d'effectuer les mesures de l'absorbance du milieu réactionnel, on doit régler la longueur d'onde de la lumière dans la gamme de longueur d'onde où la solution va absorber le plus. Dans la réaction étudiée seule l'ion permanganate est coloré. pour choisir cette longueur d'onde on effectue le spectre d'absorption d'une solution diluée de permanganate de potassium. 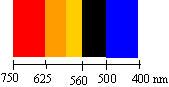
Expérience : Dans un bécher de 50 mL on mélange V1 = 10 mL d'une solution de permanganate de potassium acidifiée de concentration C1 = 0,001 mol/L. On ajoute une spatule de nitrate de manganèse II, Mn(NO3)2 ; les ions Mn2+ catalysent la réaction. On suppose que le volume de la solution ne varie pas lors de la dissolution de ce solide.A l'instant t=0, on ajoute V2=10mL d'une solution d'acide oxalique de concentration C2= 0,01 mol/L. On homogénéise le mélange et on verse immédiatement une partie du mélange dans une cellule du spectrophotomètre. Toutes les minutes on note les valeurs de l'absorbance de la solution.
La couleur perçue est la couleur complémentaire de la couleur absorbée, donc la solution de permanganate de potassium est violette. Le
spectrophotomètre doit être réglé sur la longueur d'onde donnant le
maximum d'absorption.
réduction de l'ion permanganate : 2 fois { MnO4- + 8H+ + 5e- --> Mn2+ + 4 H2O} oxydation de l'acide oxalique : 5 fois { H2C2O4 --> 2 CO2 + 2H+ + 2e- } 2MnO4- + 6H+ + 5 H2C2O4 --> 10 CO2 + 2Mn2+ + 8 H2O Quantité de matière initiale MnO4- : concentration (mol/L) fois volume (litre) = 10-3*0,01 = 10-5 mol = 0,01 mmol H2C2O4 : concentration (mol/L) fois volume (litre) = 0,01*0,01 = 10-4 mol = 0,1 mmol
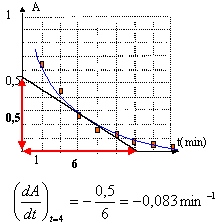
la vitesse volumique de la réaction est : v = 1/V dx/dt or A= 2000 [MnO4- ] et [MnO4- ] = (10-5-2x)/V soit A= 2000 (10-5-2x)/V et en dérivant par rapport au temps : dA/dt = 2000*(-2)/Vdx /dt ou 1/V dx/dt = -1/4000 dA/dt v(t=4 min) = 0,083/4000= 2 10-5 mol L-1 min-1. [MnO4- ]t=0 dans le mélange avant que la réaction ne débute : 10-5 / ((10+10) 10-3)= 5 10-4 mol. At=0 = 2000 [MnO4- ]t=0 = 2000*5 10-4 = 1. le temps de demi-réaction est la durée au bout de laquelle l'avancement x est égal à la moitié de la valeur de l'avancement final . La réaction étant totale l'avancement final est égal à l'avancement maximal soit xmax= 5 10-6 mol x½ = 2,5 10-6 mol [MnO4- ] = (10-5-2x)/V avec V = 0,02 L [MnO4- ] = (10-5 -2*2,5 10-6) / 0,02 = 2,5 10-4 mol/L A = 2000 [MnO4- ] = 2000* 2,5 10-4 = 0,5 lectute graphe A= f(t) : t½ = 1 min 30 s. |
||||||||||||||||||||||||||||||||||||||||||||||||
|