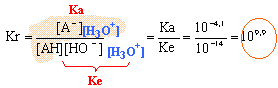|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||
|
||||||
|
|
Données : acide ascorbique C6H8O6, acide faible noté HA ion ascorbate, base conjuguée de l'acide ascorbique noté A-. pKa du couple AH/A- : 4,1 à 25°C masse molaire en g/mol : acide ascorbique :176 ; ascorbate de sodium :198. Delphine prend un comprimé de "500 mg" de vitamine C. Elle sait que la vitamine C est l'acide ascorbique. Dosage : Elle décide de procéder à un dosage par une solution de soude ou hydroxyde de sodium pour vérifier l'indication de masse de l'acide ascorbique. Elle prépare tout d'abors un volume V0=200 mL de solution aqueuse avec la totalité du comprimé. Soit S la solution obtenue.
Interprétation : Delphine s'étonne de la valeur de la masse obtenue. Elle décide alors de lire plus attentivement la notice. Elle y trouve les renseignements suivants : Vitamine C tamponnée, acide ascorbique : 247 mg, ascorbate de sodium : 284 mg , acide ascorbique total : 500 mg. Elle constate donc la présence simultanée dans le comprimé des deux formes acide et base conjuguée du couple AH/A-.
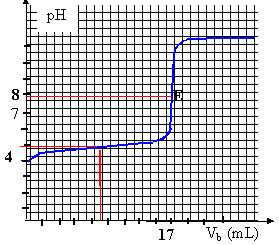
la constante étant grande, la réaction est totale. A l'équivalence les quantités de matière d'acide et de base mises en présence sont dans les proportions stoéchiométriques. CaVa = CbVb soit Ca = 17*0,02/50 = 6,8 10-3 mol/L (volume de soude à l'équivalence 17 mL, lecture graphe) soit 6,8 10-3 *0,2 = 1,36 10-3 mol dans un comprimé ( dans 200 mL) masse acide ascorbique dans un comprimé : 1,36 10-3 *176 = 0,239 g = 239 mg. masse (g) / masse molaire (g/mol) acide ascorbique : 0,247 / 176 = 1,38 10-3 mol ascorbate de sodium : 0,284 / 198 = 1,43 10-3 mol pH= pKa + log ([A-]/[AH]) pH=4,1 + log (1,38/1,43) voisin de 4,1 sur le graphe, le pH initial est proche de 4. Une solution tampon contient un couple acide base faible tel que les quantités d'acide et de base conjuguée soient égales : - par ajout modéré d'acide ou de base forte le pH de cette solution tampon varie très peu - le pH d'une solution tampon ne varie pas par dilution. à pH =1 ( valeur inférieure au pKa du couple ) la forme acide AH prédomine. pH= pKa + log ([A-]/[AH]) 1 = 4,1 + log ([A-]/(AH]) [A-]/[AH] = 10-3,1 = 8 10-4. [A-]= 8 10-4[AH] on peut considérer que la forme base conjuguée A- est négligeable devant AH en conséquence, dans l'estomac AH total voisin de : (1,38+1,43)10-3 = 2,81 10-3 mol soit en masse : 2,81 10-3 *176 = 0,494 g = 494 mg.
|
|||||
|