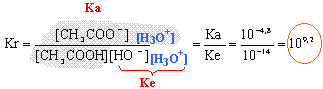|
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||
|
|
Données :
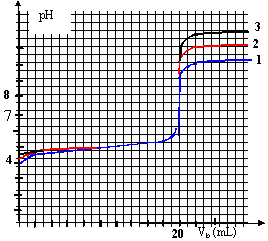
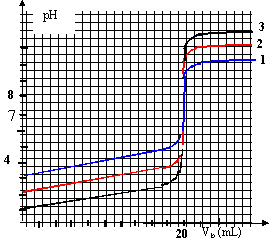
donc volume pipette = dixième du volume de la fiole jaugée prélever 5 mL de la solution mère (pipette + pipeteur) placer dans la fiole jaugée de 50 mL compléter avec de l'eau distillée jusqu'au trait de jauge. graphe 1 : pH initial voisin de 1 et pH final voisin de 13 (courbe 3) dosage acide fort base forte, le pH initial est voisin de -log ( concentration acide) = - log 0,1 = 1. graphe 2 : pH final voisin de 13 (courbe 3) dosage acide faible base forte, le pH final est proche de 14 + log ( concentration de la base) à la demi équivalence du dosage acide faible base forte, le pH est égal au pka du couple acide base : le graphe 2 indique pKa voisin de 5 donc acide éthanoïque/ ion éthanoate graphe 2 : acide faible (pKa >0) et base forte (pKa=14) CH3COOH + HO--->CH3COO- +H2O
la constante étant grande, la réaction est totale. graphe 1 : acide fort (pKa =0) et base forte (pKa=14) H3O+ + HO--->2H2O Kr=1/( [H3O+][HO-] ) = 1/10-14 = 1014. la constante étant grande, la réaction est totale. Une solution tampon contient un couple acide base faible tel que les quantités d'acide et de base conjuguée soient égales : - par ajout modéré d'acide ou de base forte le pH de cette solution tampon varie très peu - le pH d'une solution tampon ne varie pas par dilution. graphe 2 : dans la zone pH voisin de pKa on a une solution tampon. graphe 1 : la solution ne contient à aucun moment un couple acide base faible : donc pas de solution tampon. de plus les courbes ne possèdent aucune partie pratiquement horizontale. De nombreuse réactions en biologie se font dans des milieux tamponnés. on étalone le pHmètre à partir de solutions tampon de pH bien déterminé ( pH=7 et pH=4 par exemple).
|
|||||||||||||||||||||||||||
|