|
avec calculatrice En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
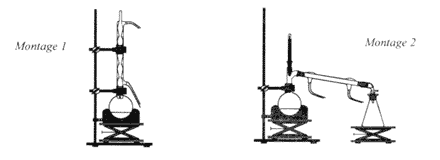
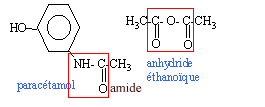
Le paracétamol estun médicament qui se rapproche de l'aspirine par ses propriétés analgésiques et antipyrétiques. Il est dépourvu d'action inflamatoire. on l'obtient par réaction entre le para-aminophénol et l'anhydride éthanoïque en milieu aqueux. 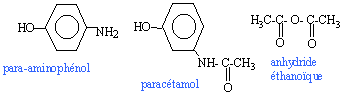 para-aminophénol : M=109 g/mol ; Tfusion = 187 °C ; solubilité dans l'eau : 0,8 g dans 100 g à 20 °C ; 8,5 g dans 100 g à 100°C. paracétamol : M= 151 g/mol ; Tfusion = 170 °C ; solubilité dans l'eau : 1 g dans 100 g à 20 °C ; 25 g dans 100 g à 100°C. anhydride éthanoïque : M= 102 g/mol ; Tfusion = -73 °C ;masse volumique 1,082 g /mL I- Synthèse d'un produit brut : - Dans un ballon à trois cols muni d'une agitation mécanique, d'un réfrigérant à reflux et d'une ampoule de coulée, introduire 10 g de para-aminophénol. - Sous vive agitation, introduire rapidement 30 mL d'eau puis unpeu plus lentement 12 mL d'anhydride éthanoïque. Porter à reflux pendant 20 min. - Refroidir puis transvaser dans un bécher. Refroidir dans un bain de glace et le paracétamol précipite. - Filtrer sous vide et laver à l'eau glacée. Essorer et sécher sur papier filtre. - Placer le produit brut obtenu à l'étuve à 80°C : on obtient alors une masse de produit brut sec P: mP= 10,8 g.
II- Purification du paracétamol : A partir du produit sec P, on réalise deux parts P1 et P2 de masse identique. On souhaite recristalliser la part P2.
III- Analyse par chromatographie sur couche mince des produits obtenus : Sur une plaque de silice sensible aux UV on effectue les dépôts suivants : E : para-aminophénol en solution dans l'éthanol ; P1 : paracétamol brut en solution dans l'éthanol ; P2 : paracétamol purifié en solution dans l'éthanol ; P3 : paracétamol issu d'un comprimé pharmaceutique en solution dans l'éthanol . L'éluant est un mélange organique complexe. Après révélation on obtient le chromatogramme suivant : 
(CH3-CO)2 O + HO-C6H4-NH2 donne CH3-COOH + HO-C6H4-NH-CO-CH3
(1) montage à reflux ; (2) : montage de distillation fractionée. Le para-aminophénol est un solide à 20°C qui devient liquide à 170°C sous une pression de 1 bar. La solubilité dans l'eau du paracétamol est très faible à 0°C ( 1g dans 100g à 20 °C) d'où la précipitation du paracétamol à cette température. filtration sous vide ou sur bûchner ; le vide partiel (
dépression sous le filtre) est crée grâce à une trompe à eau.
para-aminophénol : masse (g) / masse molaire (g/mol) = 10/109 = 9,17 10-2 mol. anhydride éthanoïque : masse (g) = masse volumique (g/mL) fois volume (mL) = 1,082*12 = 12,98 g puis masse (g) / masse molaire (g/mol) = 12,98 / 102 = 0,127 mol.
Qté de matière expérimentale xexp = masse (g) */ masse molaie (g/mol) = 10,8 / 151 =7,15 10-2 mol rendement h = xexp /xmax
=7,15 10-2 /9,17 10-2 = 0,78 (78%).
La solubilité étant d'autant plus faible que la température est plus basse, le solide cristallise lors du refroidissement. Les impuretés sont éliminées, il ne reste que le paracétamol pur. masse (g) */ masse molaie (g/mol) = 2*4,2 / 151 =5,56 10-2 mol rendement h ' = xexp /xmax =5,56 10-2 /9,17 10-2 = 0,61 (61%). le rendement réel de cette synthèse est 61 %.
les produits purs E et P2 servent de référence ( d'étalon) le comprimé pharmaceutique P3 contient du paracétamol et ne contient pas de para-aminophénol le produit P1 est impur : il contient du paracétamol et un autre corps inconnu ( mais ne contient pas de para-aminophénol). La chromatographie sur couche mince permet d'identifier les composants d'un mélange et donc de vérifier la pureté du paracétamol.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
|