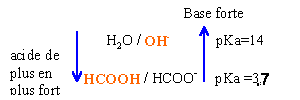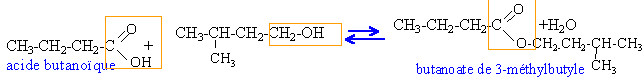|
chimie
|
||||||||||||
|
solution tampon |
|
|||||||||||
|
HCOOH + H2O en équilibre avec HCOO- + H3O+. HCOO- base faible issue du formiate de sodium réagit peu avec l'eau . [ HCOO-]=0,1 v2 / (v1+v2) = 0,1 v2 /100 = v2 10-3 (v2 en mL) HCOOH acide faible réagit peu avec l'eau . [ HCOOH ]=0,1 v1 / (v1+v2) = v1 10-3 (v1 en mL)
3,9 = 3,72 + log(v2/v1) d'où v2 / v1= 1,513 et v1+ v2
=100 ;
v1=39,8
mL ;
v2=60,2
mL
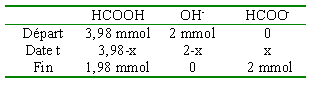
HCOOH + OH- donne HCOO- + H2O. Réaction mettant en jeu l'acide le plus fort et la base la plus forte . La différence des pKa est égale à 10,3. La réaction est donc totale. Kr = [HCOO-] / ( [HCOOH ] [ OH- ] =1010,3.
total HCOO- à la fin : 6,02+2 = 8 mmol pH=3,72 + log (8/1,98) = 4,32 variation inférieure à1%. S est une
solution
tampon.
[OH-]=0,002/0,1= 0,02 mol L-1. [H3O+]= 10-14 /0,02 = 5 10-13. pH= 12,3 au lieu de 7 (eau au départ)
|
||||||||||||
|
chimie organique |
1. Un alcool A à chaîne carbonée non ramifiée de formule C4H10O subit dans un premier temps une oxydation ménagée par le permanganate de potassium en milieu acide. Une fraction du composé B ainsi obtenu forme un précipité orange avec la DNPH et donne un précipité rouge brique avec la Liqueur de Fehling. Dans un deuxième temps, le composé B chauffé avec le dioxygène en présence de cuivre porté au rouge, donne un produit C qui confère une teinte jaune au bleu de bromothymol et rouge à l'élianthine.
H3C-CHCH3-CH2-CH2OH noté D et CH3-CH2-*CHCH3-CH2OH noté D'. On sépare ces deux isomères en ne conservant que l'alcool non chiral ; on fait réagir en quantité équimolaire le composé C avec 220 mL d'alcool achiral en présence de 1 mL d'acide sulfurique. Le produit formé a un arôme chocolaté.
Données : H=1 C=12 O=16 g mol-1 masse volumique de D ou D' = 0,8 g cm-3. corrigé |
|||||||||||
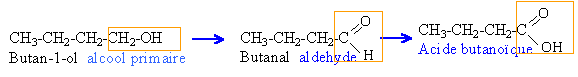
2{ MnO4- +5 e- + 8H + --> Mn2+ + 4H2O } réduction 5{ C4H10O --> C4H8O +2 e- + 2H + } oxydation 2MnO4- + 6H + + 5 C4H10O --> 5C4H8O + 2Mn2+ + 8H2O (D) : 3-méthylbutan-1-ol
esterification, lente, athermique, limitée par l'hydrolyse de l'ester. masse d'alcool : 220 *0,8 =176 g masse molaire alcool : 88 g mol-1. 176 / 88 = 2 mol alcool. donc 2 mol d'ester si réaction totale. masse molaire ester : 158 g mol-1. masse théorique d'ester : 2*158 = 316 g pour augmenter le rendement de l'esterification : mettre un excès d'alcool ou d'acide éliminer l'ester du milieu réactionel au fur et à mesure qu'il se forme remplacer l'acide par le chlorure d'acyle ou l'anhydride d'acide correspondante.
|