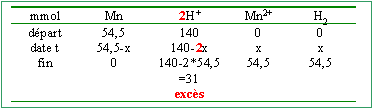| |
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
| |
|
||||||
|
|
alliage( Zn, Al, Cu, Mg) |
Le zamak-5 est un alliage de zinc, d'aliminium(4%), de cuivre(1%), et de magnésium(0.05%).
corrigé |
|||||
| |
Zn + 2 H+ -->H2 + Zn2+. Mg + 2 H+ -->H2 + Mg2+. le cuivre n'est pas attaqué.
masse de zinc : 5 *(1-0,04-0,01-0,0005)=4,747g divisé par la masse molaire du zinc : 4,747 /65,4 =0,073 mol soit 2*0,073 =0,146 mol d'acide soit 0,073 mol ion Zn2+. masse de magnésium : 5 *0,0005=0,0025g divisé par la masse molaire du magnésium : 0,0025 /24,3=10-4 mol soit 2*10-4 mol d'acide soit 10-4 mol ion Mg2+. masse d'aluminium : 5 *0,04=0,2g divisé par la masse molaire de l'aluminium : 0,2 /27 = 0,0074 mol soit 3*0,0074 =0,0222 mol d'acide soit 0,0074 mol ion Al3+. total pour l'acide :0,1684 mol ou 168,4 mL [Zn2+]=0,073/0,1684 =0,432 mol L-1. [Al3+]=0,0074/0,1684 =0,044 mol L-1. [Mg2+]=10-4/0,1684 =0,006 mol L-1. [Cl-]= 1 mol L-1.
|
||||||
|
acide sulfurique et manganèse |
Un volumeV=20 mL d'une solution d'acide sulfurique diluée de concentration C=3,5mol/L réagit totalement avec une masse m=3,0 g de manganèse. Il se forme des ions Mn2+
corrigé |
||||||
| |
le réducteur le plus fort d'un couple réagit spontanément avec l'oxydant le plus fort de l'autre couple. Cu2+ / Cu H+ /H2 Mn2+/Mn on ne peut pas classer les couples Mn2+/Mn et Fe2+/Fe Mn +2H+ --> H2+ Mn2+. Quantités de matière et réactif en excès. l'acide sulfurique est un diacide fort : 0,02*3,5= 0,07 mol d'acide mais 0,14 mol d'ion hydronium
[Mn2+]=0,0545/0,02 =2,72 mol L-1. [H+]=0,031/0,02 =1,55 mol L-1. [SO42-]= 3,5 mol L-1. la solution reste électriquement neutre : 2[Mn2+] + [H+] = 2[SO42-]
|
||||||
|
ion argent et poudre de fer |
On ajoute de la poudre de fer en excès dans V=10 ml d 'une solution de nitrate d'argent de concentration C=0,1 mol/L. On agite la solution puis on la filtre. On ajoute quelques gouttes d'une solution d'hydroxyde de sodium de concentration C=3mol/L dans le filtrat ,il se forme un précipité vert.
corrigé
|
||||||
| |
Fe + 2 Ag+ --> Fe2+ + 2 Ag 10*0,1 = 1 mmol d'ion argent Ag+réagit avec 0,5 mmol de fer soit 5 10-4 *56 = 28 mg de fer 5 10-4 mol d'ion Fe2+ dans 0,01 L soit [Fe2+] =0,05 mol L-1. [NO3-] =0,1 mol L-1 la solution est bien électriquement neutre : [NO3-] = 2[Fe2+] Fe2+ + 2 OH- --> Fe(OH)2 à partir de 5 10-4 mol d'ion Fe2+ il faut 10-3 mol de soude soit 10-3/3= 3.33 10-4 L=0,33 mL 0,33 /0,05 = 6,66 soit 7 gouttes |
||||||
| |
|
||||||
|
|
|