| |
décomposition de l'eau oxygénée France bac 09 / 2000 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||||||||
|
|
oxydo-réduction dilution facteurs cinétiques
|
L’eau oxygénée ou solution aqueuse de peroxyde d’hydrogène H2O2 est une espèce oxydante utilisée au laboratoire. Il s’agit aussi d’une espèce chimique utilisée dans la vie courante : décoloration des cheveux, désinfection des verres de contact, désinfection des plaies. Sa décomposition, qui produit un dégagement de dioxygène, est accélérée par certains facteurs comme l’exposition à la lumière, l’ion fer (II), l’ion fer (III), le platine… On se propose d’étudier la cinétique de la réaction de décomposition du peroxyde d’hydrogène réalisée en présence de l’ion fer (II). L’équation-bilan de cette réaction est : 2 H2O2.donne O2 + 2 H2O réaction (1) On réalise le protocole expérimental suivant : •On prépare huit bechers contenant chacun V0 = 10,0 mL d’une solution aqueuse de peroxyde d’hydrogène de concentration [H2O2]0 = 5,8 × 10 -2 mol.L -1 . •On les place dans une enceinte thermostatée qui maintient la température à la valeur . t1 = 20 °C. •À la date to = 0 s, on ajoute dans chaque becher quelques gouttes d’une solution contenant des ions fer (II). Il se produit alors la réaction (1). •À la date t, on prend un des huit bechers. On ajoute une grande quantité d’eau glacée dans celui-ci. On acidifie le contenu de ce becher en ajoutant quelques gouttes d’acide sulfurique concentré. •À l’aide d’une solution aqueuse de permanganate de potassium fraîchement préparée, de concentration C = 1,0 × 10 -2 mol.L -1 , on dose le peroxyde d’hydrogène restant dans le becher. On note V le volume versé de solution aqueuse de permanganate de potassium pour obtenir l’équivalence d’oxydoréduction. L’équation-bilan de la réaction de dosage est : 2 MnO4 - + 5 H2O2 + 6 H3O +donne.2 Mn 2+ + 5O2 + 14 H2O réaction (2)
À propos du protocole
Préparation préalable de la solution de permanganate de potassium Un élève doit préparer 200,0 mL de solution aqueuse de permanganate de potassium de concentration C = 0,01 mol.L -1 à partir d’une solution (notée S) de permanganate de potassium de concentration CS = 0,1 mol.L -1 .Pour réaliser cette opération, il prélève 10,0 mL de solution S contenue dans un verre à pied, à l’aide d’une pipette jaugée. Il verse le prélèvement dans un becher et complète avec de l’eau distillée jusqu’à la graduation 200 mL. Cet élève a commis deux erreurs. Lesquelles ? Comment les corriger ? Étude de la réaction de décomposition de l’eau oxygénée à la température t1 = 20°C 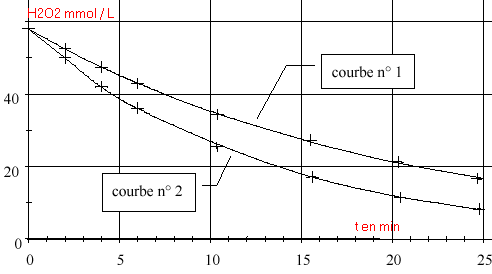 On a représenté la concentration en peroxyde d’hydrogène restant en fonction du temps (courbe 1) . On mesure la vitesse instantanée volumique aux instants t = 12 min et t' = 20 min. On trouve 1,1 mmol L-1 min-1 et 1,6 mmol L-1 min-1 .
Étude de la réaction de décomposition de l’eau oxygénée à la température de 40 °C On recommence les mêmes expériences que précédemment mais l’enceinte thermostatée est maintenue à la température t2 = 40 °C. On obtient la courbe 2 (voir graphe).
Expression de la concentration en [H2O2] restant en fonction du temps Pour tracer les courbes 1 et 2, on a dû calculer la concentration [H2O2] en peroxyde d’hydrogène restant à chaque instant de date t. Établir l’expression de la concentration [H2O2] en peroxyde d’hydrogène restant à une date t en fonction de C concentration de KMnO4 ,V et V0.
|
||||||||||||
| |
10 mL d'eau oxygénée sont prélevés à l'aide d'une pipette jaugée surmontée d'un pipeteur La température est un facteur cinétique : la vitesse d'une réaction croît avec la température. l'eau glacée provoque un blocage cinétique de la réaction (1) de décomposition de l'eau oxygénée.
Le permanganate de potassium joue un double rôle, celui de réactif et celui d'indicateur coloré, MnO4- étant le seul ion très coloré (violet foncé) erreur commise : il faut utiliser une fiole jaugée de 200 mL afin que la mesure du volume 200 mL soit précise. Ne pas utiliser de bécher, ce serait trop imprécis. La fiole jaugée doit contenir un peu d'eau distilée, ajouter ensuite les 20 mL prélevés et non pas 10 mL. diluer 10 fois c'est prélever 20 mL de solution mère pour un volume final de 200 mL Le verre à pied sera remplacé par un bécher ou un erlenmeyer.(plus grande stabilité) une vitesse de réaction est toujours positive vitesse de disparition de l'eau oxygénée = - variation de la quantité (négative dans ce cas) de matière d'eau oxygénée divisée par la durée de cette variation. Sur le graphique cette vitesse correspond à la valeur absolue du coefficient directeur de la tangente à la courbe au point considéré. La vitesse étant proportionnelle à la quantité de matière d'un réactif, elle diminue lorsque la quantité de matière d'eau oxygénée diminue La plus grande valeur correspond à 12 minutes. temps de demi réaction : lecture graphe (1) Quantité initiale d'eau oxygénée initiale voisine 58 mmol L-1. diviser par 2 soit 29 mmol L-1. tracer une horizontale passant par 29 mmol/L puis une verticale à partir de l'intresection avec la courbe (1). On lit t1 voisin de 13 min. même méthode avec la courbe (2) . On trouve t2 voisn de 8 min interprétation : la vitesse d'une réaction augmente lorsque la température augmente. au départ : 5,8 10-2 V0 mol H2O2. à l'équivalence du dosage redox : CV mol permanganate et V0[H2O2] mol d'eau oxygénée restant en solution
2V0[H2O2] =5 CV [H2O2] = 2,5 CV / V0
|
|||||||||||||
|
|
|