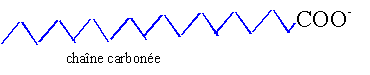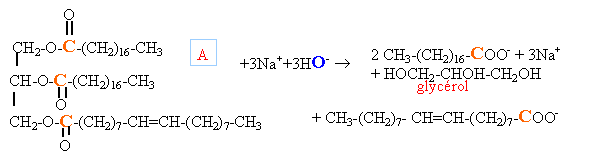| |
la mousse du savon . En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||
|
|
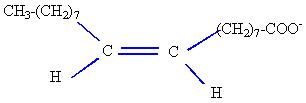
saponification isomèrie Z E pouvoir nettoyant
|
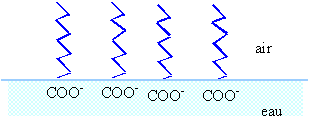
La mousse du savon est due à un ensemble de phénomènes physiques : la tension superficielle de l'eau d'une part, et les propriétés du savon, d'autre part, sont responsables de la formation de la mousse... Les savons sont des sels de sodium ou de potassium d'acides gras et contiennent 13 à 19 atomes de carbone. Ils sont obtenus par hydrolyse alcaline des graisses animales et végétales. Cette réaction s'appelle la saponification. C'est probablement l'une des plus vieilles réactions chimiques connues de l'humanité puisqu'elle servait aux Celtes et aux Romains. Les savons possèdent des molécules formées par un groupe polaire hydrophile (attiré par l'eau) et un groupe hydrophobe, qui est en même temps lipophile (qui retient les substances grasses). L'extrémité qui comporte ce dernier groupement est donc attirée par la graisse mais déteste l'eau. Dans l'eau, les molécules de savon ont ainsi un comportement bien particulier. Les salissures à base de graisse se trouvent entourées par les pôles lipophiles-hydrophobes des molécules de savon. Lors du rinçage, les complexes formés par les molécules de graisse et les molécules de savon sont éliminés. D'où le pouvoir nettoyant de ce dernier. Mais à la surface de l'eau, indépendamment de la graisse, la particularité des molécules de savon leur fait prendre une position spécifique : le pôle hydrophobe de chaque molécule reste en dehors de l'eau, formant une couche pratiquement unimoléculaire en surface. Le pôle hydrophile reste dans l'eau, très proche de la surface. Un équilibre stable s'établi, qui fait que le savon, à cause de ses pôles hydrophobes, se retrouve à la surface de l'eau. Questions relatives au texte.
Le pouvoir nettoyant du savon.
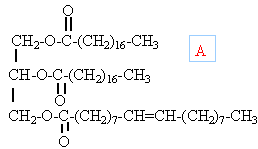
On donne les masses molaires suivantes exprimées en g.mol-1 : M(H) = 1 ; M(C) = 12 ; M(O) = 16 ; M(Na) = 23. Masse molaire du composé A : M(A) = 888.
|
|||||
| |
de ce fait le terme molécule ( édifice électriquement neutre) ne doit pas être employé graisses : triesters d'acide gras (longue chaîne carbonée) et du glycérol saponification ou "hydrolyse alcaline".
C carbone en rouge : site électrophiles , appauvris en électrons O oxygène en bleu : site nucléophile, riche en électrons.
Quantité de matière d'huile : 1 000 000 / 18*12 1000 000 / 888 = 1126,1 mol donc 2*1126,1 =2252,2 mol C18H35O2Na (M=306 g/mol) ou bien 2252,2*306= 689,17 kg donc 1126,1 mol C18H33O2Na (M=304 g/mol) ou bien 1126,1*304= 342,33 kg total savon : 1031,5 kg en tenant compte du rendement :1031,5*0,8 = 825,2 kg. groupe hydrophile : groupe carboxylate COO-. groupe hydrophobe : squelette carboné par son extrémité hydrophobe (ou lipophile) le savon fixe les graisses. par son extrémité hydrophile le savon solubilise les graisses.
|
||||||
|
|
|