En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
| .
. |
| .
. |
- Le numéro atomique de
l'élément iode est Z=53 :
- Quelle est sa configuration électronique dans l'état fondamental. Quel est le nombre d'électrons de valence ? D'électrons de nombre quantique secondaire égal à 2 ?
- Donner le schéma de Lewis de l'atome d'iode. A quel famille d'éléments chimiques appartient-il ? Citer deux autres éléments appartenant à cette famille.
- Donner le schéma de Lewis de l'ion iodure I-, du diiode I2 et de l'ion iodate IO3- ( l'iode est l'atome central) En déduire la géomètrie de l'ion iodate en précisant l'angle approximatif entre deux liaisons iode-oxygène de cet ion.
- Sous quel état physique trouve-t-on le diiode pur à 25°C. Pourquoi sa solubilité dans l'eau est-elle faible ? - Energie d'attachement électronique de
l'iode : dans l'approximation, de Slater
l'énergie d'un électron de nombres
quantiques n et l est donné par la relation
En,l = -13,6 [Z* / n*]2 en
eV, où n* est le nombre quantique apparent. On
pose Z*=Z-s, où
s est la constante
d'écran.

- Rapeler la définition de l'énergie d'attachement électronique et écrire l'équation bilan de la réaction associée.
- Donner la signification physique de Z*.
- En utilisant les coefficient de Slater donnés ci-dessus, déterminer en eV l'énergie d'un électron de la couche de valence de l'atome d'iode.
- Déterminer de même l'énergie d'un électron de la couche de valence de l'ion iodure.
- Calculer l'énergie d'attachement électronique de l'iode en précisant clairement le raisonnement. Comment expliquer l'écart important par rapport à la valeur expérimentale de - 3,44 eV ?
- Comment évolue l'énergie d'attachement électronique quand on se déplace de la gauche vers la droite dans une même période de la classification périodique ? Justifier.
corrigé
configuration électronique de l'atome de diiode dans son état fondamental :
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5.
7 électrons de valence ( 2 électrons 5 s et 5 électrons 5p)
20 électrons de nombre quantique secondaire l=2 ( sous-couches 3d et 4 d )
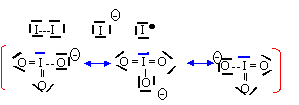
L'ion IO3- est du type AX3E et a une structure pyramidale à base triangulaire avec des angles de liaisons de 109,5°.
le diiode se trouve sous forme solide cristallisé à la température de 20°C ; de couleur gris violet.
Il est peu soluble dans l'eau, la molécule de diiode est apolaire alors que l'eau est un solvant polaire.
l'énergie d'attachement électronique, notée Eatt est l'énergie interne standart de réaction à la température de 0 K, associée à la réaction : I(gaz) + e- --> I-(gaz)
C'est l'énergie de formation de l'ion I- par fixation d'un électron sur l'atome gazeux d'iode.
Dans un atome polyatomique, un électron est soumis à l'attraction du noyau positif ( charge Ze) et à la répulsion des autres électrons négatifs : on peut imaginer l'électron soumis à un noyau fictif de charge effective +Z*e. On calcule Z* on retranchant à Z une charge fictive s, ( constante d'écran ) représentant la répulsion moyenne des autres électrons.
Slater :
configuration électronique de l'atome de diiode dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p5.
Z*5s,5p = 53-(2*1+8*1+18*1+18*0,85+6*0,35)= 7,6 ; n*=4 ;
énergie d'un électron de la couche de valence : E5s,5p= -13,6[7,6/4]2= -49,1 eV.
configuration électronique de l'ion iodure dans son état fondamental : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s2 5p6.
Z*5s,5p = 53-(2*1+8*1+18*1+18*0,85+7*0,35)= 7,25 ; n*=4 ;
énergie d'un électron de la couche de valence : E'5s,5p= -13,6[7,25/4]2= -44,7 eV.
Eatt = énergie de l'ion I-(gaz) - énergie de l'atome I(gaz)= E(I-gaz) - E(I gaz)
énergie de l'atome I(gaz) = énergie des électrons de coeur + énergie des électrons de valence= E0+ 7*(- 49,1)
énergie de l'ion I-(gaz) = énergie des électrons de coeur + énergie des électrons de valence= E0+ 8*(- 44,7)
Eatt =8*(- 44,7)-7*(- 49,1) = -13,9 eV.
Le modèle de Slater est approximatif ( d'où l'écart de valeur par rapport à la valeur expérimentale -3,44 eV)
les électrons ns et np n'ont ni la même constante d'écran, ni la même énergie.
Dans une même période, en se déplaçant de gauche à droite, la valeur absolue de l'énergie d'attachement électronique augmente : l'électronégativité augmente ; l'atome gagne de plus en plus facilement un électron.