| .
. |
|
|
|
|
|
|
calculs de concentrations
- Quelles sont les concentrations des ion Ca2+, Na+, Cl- ?
- Vérifier que la solution est électriquement neutre.
..
|
|
|
|
|
|
0,02*0,5=0,01 |
|
0,02*0,5=0,01 2*1,39/111=0,025 |
|
|
|
|
|
|
0,28 +2*0,05=0,38
iodure et peroxodisulfate
Au départ , avant mélange des solutions, ,les quantités de matière des réactifs sont égales ( 0,2 mol de chaque réactif). Quelle est la composition finale du mélange en moles ?
..
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
mélange de solutions H3CCOOH et H3CCOO-.
On mélange 10 mL d'acide éthanoique à 0,1 mol L-1 et 40 mL de solution d'acétate de sodium à 0,1 mol L-1.
- Quels sont les concentrations finales des ions acétate, sodium et d'acide acétique ? On négligera les réactions de l'acide acétique et de l'ion acétate avec l'eau.
- La solution est -elle une solution tampon ?
- Quel est le pH du mélange si le pKa du couple mis en jeu est 4,8 ?
..
Qté matière (mol)= volume (L) fois concentration (mol L-1)
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
pH d'une solution contenant un couple acide base
pH = pKa + log ([base conjuguée]/ [acide] )
pH=4,8 + log(0,02/0,08)=5,4.
autoprotolyse de l'eau
- Quelles sont les quantités de matière en mol des espèces présentes en solution ?
- La température change, comment évoluent ces valeurs ?
- A partir de quelles concentrations faut-il tenir compte des ions issus de l'autoprotolyse
.
Qté matière (mol)= volume (L) fois concentration (mol L-1)
0,1*10-7=10-8 mol dion hydronium ou hydroxyde.
masse de 100 mL d'eau : 100g ; masse molaire de l'eau 16+2 =1 8 g mol-1.
Quantité de matière (mol)= masse(g) / masse molaire(gmol-1)
100/18=5,55
mol d'eau
La valeur Ke du produit ionique de l'eau diminue si la
température augmente.
Les concentrations des ions
hydroxyde et hydronium diminuent. La concentration en
molécule d'eau ne change
pas.Dans ces conditions le pH
d'une solution neutre est plus petit que 7.
Si la concentration de l'acide
ou de la base est inférieure à 10-6
mol L-1 il faut tenir compte des ion hydronium ou
hydroxyde issus de l'eau.
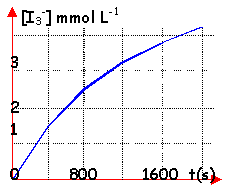
cinétique de formation des ions triiodure I3-.
H2O2 + 2H+ + 3I- donnent 2H2O + I3-
On mélange 10 mL de solution acidifiée d'eau oxygénée à 0,01 mol L-1 et 10 mL de solution de iodure de potassium KI à 0,2 mol L-1. On détermine la concentration [ I3-] en fonction du temps par comparaison de la couleur de la solution à celle d'échantillons.
- Comment évolue la vitesse de formation des ions triiodure ?
- A t=1600 s calculer la concentration en ion iodure I-.
- Quel est le facteur limitant ?
- Quelle est la vitesse de la réaction à t=800 s ?
..
La vitesse, à une date donnée, est le coefficient directeur (en valeur absolue) de la tangente à la courbe à cette date . Ce coefficient diminue au cours du temps.
lecture graphique à t=1600 s [
I3-]=
3,5 mmol
L-1.
soit dans 20 mL : 3,5*20 10-3 = 0,07 mmol d'ion I3- formé
soit 3*0,07 = 0,21 mmol d'ion I- ayant réagi
or au départ il y avait dans 10 ml :10*10-3*0,2= 2 mmol d'ion I-
donc il en reste: 2-0,21 = 1,79 mmol d'ion I- dans 20 mL de solution
[I-]=
1,79 10-3/20 10-3 =
0,09 mol
L-1.
Quantité de matiére :
H2O2 : volume (L) fois concentration (mol L-1)=10 10-3*10-2=0,1 mmol
ion iodure : 10 10-3*0,2=2 mmol
à partir de 0,1 mmol d'eau oxygénée il faut 0,3 mmol d'ion iodure.
L'eau
oxygénée est en défaut.
coefficient directeur de
la tangente à la date t=800 s=vitesse
environ 2,3 10-3 mmol L-1 s-1.
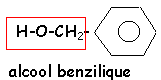
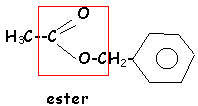
composés organiques oxygénés
L'hydrolyse de A (C9H10O2 ) conduit à un acide carboxylique C et à un alcool D.
- Quelle fonction chimique possède A ?
- La formule de C est C2H4O2 Donner son nom et écrire sa formule semi développée.
- Quelles sont les caractéristiques de la réaction ci dessus ?
- Quelle est la formule brute de D , Il s'agit d'alcool benzilique, écrire sa formule semi développée.
- Ecrire la formule semi développée de A.
.
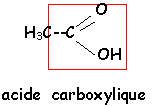
catalyse héterogène H2O2 et platine.
On verse 10 mL d'une solution S d'eau oxygénée dans une fiole jaugée de 100 ml et on complète avec de l'eau distilée jusqu'au trait de jauge. On obtient la solution S'. On dose 10 mL de S' acidifiée par une solution de permanganate de potassium à 0,02 mol L-1. Il faut verser 20 mL de cette solution de KMnO4 pour observer une teinte rose persistante.
- Quel(s) rôle(s) joue KMnO4 ?
- Equilibrer l'équation bilan ci contre . MnO4- + 5H2O2 + H+ donnent Mn2+ + O2 + H2O
- Quelles sont les concentrations de S et S' ?
- Dans 50 mL de S' acidifiée, on place un disque de platine. On laisse agir 20 minutes et on dose 10 mL de cette solution par la même solution de KMnO4 . Il faut verser 18 mL. Quel est le rôle du platine? La décomposition de l'eau oxygénée en O2 et eau est-elle rapide ?
.
c'est l'indicateur de fin de réaction MnO4- (couleur violette) est le seul ion coloré dans cette réaction de dosage. Tant qu'il y a de l'eau oxygéné MnO4- réagit en donnant l'ion Mn2+ incolore. Quant l'eau oxygéné a disparu MnO4- est présent en solution.
2MnO4- + 5H2O2 + 6H+ donnent 2Mn2+ + 5O2 + 8H2O
Qté de matière d'ion permanganate: (mol) =volume(L) * concentration mol L-1.
20 10-3 * 0,02 =0,4 10-3 mol = 0,4 mmol.
0,4 mmol d'ion permanganate réagit avec 2,5*0,4= 1 mmol H2O2.
1 mmol
H2O2
est présent dans 10 mL
de solution :
[S']= 0,1 mol L-1 et [S]= 1 mol
L-1
catalyse
héterogéne: le platine est un métal
plongeant dans la solution d'eau
oxygénée.
Qté de matière d'ion permanganate: (mol) =volume(L) * concentration mol L-1.
18 10-3 * 0,02 =0,36 10-3 mol = 0,36 mmol.
0,36 mmol d'ion permanganate réagit avec 2,5*0,36= 0,9 mmol H2O2.
0,9 mmol H2O2 est présent dans 10 mL de solution : [S']finale= 0,09 mol L-1.
10% d'eau oxygénée s'est décomposée en 20 minutes
l'acétanilide
L'acétanilide est obtenu par réaction entre l'aniline et l'anhydride éthanoique. C=12; H=1; N=14 gmol-1.
- Ecrire la formule semi dévelopée de l'acétanilide.
- Ecrire l'équation bilan.
- A partir de 0,11 mol d'aniline et 0,17 mol d'anhydride éthanoique, quelle masse d'acétanilide peut-on obtenir ?
..
|
|
|
||
 |
|
||
degré d'un vinaigre
Le vinaigre est une solution d'acide éthanoique. Son degré d'acidité représente le % massique d'acide acétique pur en solution. pKa =4,8 pour le couple acide éthanoique / ion éthanoate.
- réaction entre l'acide éthanoique et la soude: écrire l'équation bilan et calculer la constante Kr.
- réaction entre le vinaigre et la soude: on dilue 10 fois le vinaigre. 20 mL de cette solution diluée sont dosés par 24 mL de soude à 0,1 mol L-1. Quel est le degré du vinaigre ?
.
la base la plus forte HO- réagit naturellement avec l'acide le plus fort H3CCO2H . La constante de cette réaction est d'autant plus grande que les pKa sont distincts.
Kr= 10-4,8 / 10-14 =
109,2.
La réaction est totale.
A
l'équivalence
CaVa=CbVb
Ca=24 10-3*0,1 / 20 10-3= 0,12 mol L-1.
en tenant compte de la dilution ,
la concentration du vinaigre est 1,2 mol L-1.
masse de vinaigre dans 1 L= masse molaire gmol-1 * concentration
masse d'acide dans 1 L=(2*12+2*16+4)*1,2= 72g
soit 72/1000 *100=7,2% en masse degré=7,2
H3CCO2H /H3CCO2- 4,8
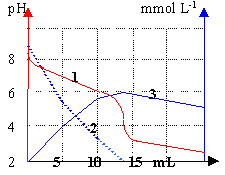
dosage ion hydrogénocarbonate HCO3- étude de courbes
Une solution d'ion hydrogénocarbonate est dosée par une solution d'acide chlorhydrique à 0,01 mol L-1. 2 et 3 correspondent aux concentrations
- Commenter chaque courbe.
- Quel est le pKa du couple CO2/HCO3-
- Pourquoi le pH à l'équivalence est-il inférieur à 7 ?
..
(2) évolution de la concentration en ion HCO3- au cours du dosage.
(3)
évolution de la
concentration en CO2
dissout
au cours du
dosage.Au delà de
l'équivalence la qté de gaz dissout n'augmente
plus mais le volume de la solution augmente, donc la
concentration en CO2
diminue.
A la demi
équivalence d'un dosage acide fort base
faible, le pH est égal
au pKa du couple acide basemis en jeu. Lecture graphe
(1)
pour V=7 mL acide ajouté.
le pKa est proche de
6,5
HCO3-
+
H3O+
donnent
CO2 + 2
H2O
A l'équivalence les deux réactifs ont disparu; la solution contient un acide CO2 dissout ,donc pH inférieur à 7.
retour - menu