|
|
|
|
eau oxygénée : catalyse par les ions Fe3+
L'eau oxygénée H2O2 intervient dans deux couples redox H2O2/H2O (+1,77 V) et O2/H2O2 (0,68 V) .Dans l'eau oxygénée, on verse quelques gouttes d'une solution aqueuse de chlorure de fer(III) : on constate un dégagement gazeux de dioxygène. (répondre vrai ou faux)
- L'eau oxygénée est un corps qui se décompose spontanément et lentement en dioxygène et eau.
- La solution de chlorure de fer(III) réalise une catalyse homogène de la réaction étudiée.
- Les ions Fe3+ ne participent pas à la réaction de l'équation bilan
- On recueille 300 mL de dioxygéne en 30 min. On en déduit que la vitesse moyenne de formation du dioxygène est égale à 4,2 10-4 mol min-1 volume molaire 24 mol L-1.
..
vrai les ions fer(IIi) sont dans la solution d'eau oxygénée. Le métal platine réaliserait une catalyse hétérogène.
vrai Un catalyseur accèlère la réaction; il est régénéré à la fin et n'intervient pas dans le bilan
vrai Qté de matière du gaz O2 :0,3 / 24 = 0,0125 mol
vitesse moyenne de formation O2 :0,0125 / 30
4,2 10-4 mol min-1
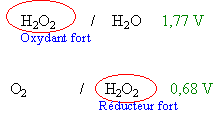
acide nitrique et réaction avec cet acide
L'acide nitrique HNO3 est un acide fort. On dispose d'une solution A d'acide nitrique de concentration cA=0,05 mol L-1.(répondre vrai ou faux)
- Le pH de cette solution est 2,7
- En mélangeant 20 mL de A à de l'eau distillée pour obtenir un volume final de 100 mL, on obtient une solution de concentration 0,01 mol L-1.
- En mélangeant 10 ml de A à 25 mL d'une solution d'éthanoate de sodium de concentration 0,02 mol L-1 on obtient une solution de pH=7.
- L'ion nitrate est en solution une base plus forte que l'ion chlorure.
..
vrai le volume de la solution est multiplié par 5 (dilution 5 fois) et les ions hydronium apportés par l'eau sont en quantité négligeable : la concentration de l'acide est divisée par 5
faux On réalise un dosage acide fort base faible . Les quantités d'acide et de base mis en présence (0,5 mmol) correspondent à l'équivalence acide base.
H3O+ +H3COO- donne H2O + H3CCOOH
la solution finale est une solution d'acide éthanoique pH<7
faux Les ions nitrate et chlorure ne sont pase des bases ; ils restent indifférents en solution
réactions prépondérantes - solution tampon
Dans 1 litre d'eau à 25 °C on introduit, sans modifications de volume,
- 0,1 mol de chlorure d'hydrogène
- 0,05 mol de soude
- 0,1 mol d'acétate de sodium pKa du couple ac éthanoique / ion éthanoate 4,8
- la première réaction pépondérante qui a lieu s'écrit H3O+ +OH- donne 2 H2O
- la seconde réactionprépondérante s'écrit H3CCOO- +H3O+ donne H3CCOOH+ H2O cette réaction peut être considérée comme totale.
- la réaction entre les ions éthanoate et l'eau est pratiquement inexistante.
- Le pH de la solution est voisin de 4,8
..
vrai l'ion éthanoate est la base la plus faible et l'eau l'acide le plus faible KR=10-9,2.
vrai 0,05 mol d'ion HO- réagit avc 0,05 mol H3O+ issu de HCl
0,05 mol d'ion éthanoate réagit avc 0,05 mol H3O+ issu de HCl donnant 0,05 mol H3CCO2H
il reste 0,05 mol d'ion H3CCO2-
c'est une solution tampon de pH=pKa=4,8
(Qté de matière d'acide faible =Qté de matière base conjuguée)
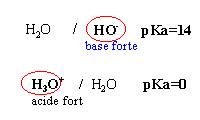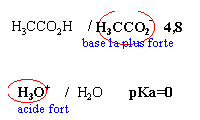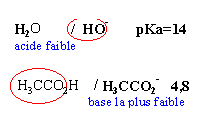
..
couple acide base - pKa
De nombreuses eaux naturelles sont gazeuses car elles contiennent du dioxyde de carbone dissous. Les équilibres sont ( voir ci contre)
- Dans l'équilibre (2) l'eau joue le rôle d'un acide
- l'ion hydrogénocarbonate est un ampholyte
- les eaux minérales gazeuse contiennent plus d'ion HCO3- que d'ion CO32-
- Si on verse du jus de citron dans ces eaux on constate un dégagement gazeux
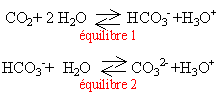
.
vrai le pH de ces eaux est voisin de 7 et le pKa du couple cité est égal à 10,4. En dessous de cette valeur, l'acide HCO3- prédomine.
vrai l'acide citrique est plus fort que CO2 ; il réagit sur la base HCO3- en donnant du CO2
estérification - montage de distillation fractionnée
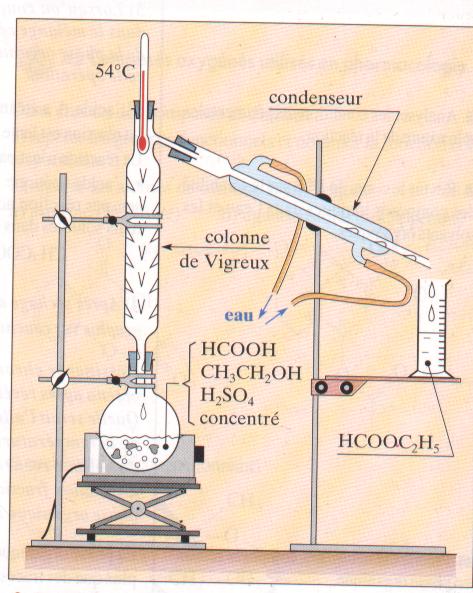
Dans le ballon du montage représenté on introduit 23g d'acide méthanoique , 23 g d'alcool pur, 1 mL d'acide sulfurique concentré et quelques grain de pierre ponce. Le chaufe ballon porte ce mélange à ébullition.
|
|
|
|
|
|
|
|
|
|
|
|
- la pierre ponce est un catalyseur
- on recueille dans l'éprouvette du méthanoate d'éthyle
- alors que le mélange bout et pendant qu'il coule du liquide , le thermomètre affiche 100°C
- Avec ce dispositif il est possible en théorie de recueillir 37 g de produitdans l'éprouvette.
..
la seconde affirmation est vraie.
faux. l'ester, le plus volatil distille et le thermomètre indique 54 °C tant que l'ester distille, ensuite suivant l'intensité du chauffage la température agmente ou diminue
vrai Ce dispositif élimine l'ester au fur et à mesure qu'il se forme. L'équilibre entre les 4 composés( alcool, acide ester et eau) est déplacé dans le sens formation de l'ester.
Initialement , 0,5 mol d'acide et o,5 mol d'alcool :on peut , en théorie, obtenir à partir de 0,5 mol d'acide , 0,5 mol d'ester soit 37 g.
formation de diiode : facteurs cinétiques
On réalise l'expérience dans différentes conditions
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
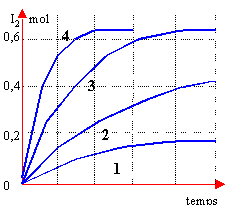
- la courbe 4 correspond à l'expérience a
- la courbe 1 correspond à l'expérience b
- les courbes 2 et 3 correspondent respectivement à c et d
- Pour une température donnée et sans catalyseur, on a ici un type de réaction pour lequel le temps de demi réaction est indépendant de la concentration.
.
la concentration des réactifs est grandes la température est plus élevée l'on emploie un catalyseur
c correspond à 3
a correspond à 2
d correspond à 1
faux les courbes 1 et 2 correspondent à la question (température identique et pas de catalyseur) . Les durées au bout desquelles la moitié des réactifs initiaux ont disparus sont différents d'après les graphes.
dosage d'un acide faible par une base forte
On neutralise un volume V=10mL d'une solution S d'acide salicylique (C7H6O3) par 12 mL d'une solution de soude de concentration 0,01 molL-1.
- La concentration de la solution S est égale à 0,012 molL-1.
- Le pKa du couple ac salicylique / ion salicylate est voisin de 8
masse atomique molaire g mol-1 : C=12 ; O=16 ; H=1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- La solution S a été obtenue par dissolution de 828 mg d'acide salicylique dans 500 mL d'eau.
- On dose le même volume d'acide chlorhydrique de même concentration que S par la même solution de soude. L'équivalence est obtenue pour un volume de soude supérieur à 12 mL
.
CA VA =CB VB d'où CA=12*0.01/10= 1,2 10-2 mol L-1
faux à la demi équivalence de la réaction de dosage d'un acide faible par une base forte, le pH est égal au pKa soit d'après le tableau pKa=3
vrai masse molaire de l'acide salicylique 138 g mol-1
Qté de matière 0,828/138=6 10-3 mol dans 0,5 L ; 12,10-3 mol L-1
faux Dans les deux cas la Qté de matière d'acide initiale est la même( peu importe que l'acide soit entierement ou partiellement dissocié) même volume de soude
acide fort et acide faible.
On dispose de deux solutions S1 et S2 d'acide de concentration C. On dilue ensuite 100 fois ces solutions. On mesure le pH avant et après dilution.
|
|
|
|
|
|
|
|
|
|
|
|
- L'acide de la solution S1 est plus forte que l'acide de la solution S2.
- Les deux acides sont faibles.
- La concentration C de la solutionS1 est 0,01 mol L-1
- A égale concentration et forte dilution , le pH des solutions des deux acides est la même.
..
faux S1 est un acide fort: en diluant 100 fois cette solution le pH augmente de 2 unités
vrai la relation pH=-log(c) est vérifiée pour S1.
vrai à très forte dilution le pH de ces deux solutions se rapproche de 7.
chromatographie - identifier les constituants du mélange
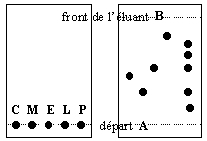
Sur la ligne A on dispose des gouttes de citral (C), de menthol (M), d'eucalyptol (E), de limonène (L), du produit à analyser (P). Après élution et révélation on obtient l'aspect de la plaque de droite.
- il faut que le niveau de l'éluant dans le récipient utilisé soit plus élevé que la ligne A sur laquelle on a disposé les réactifs.
- le produit ne contient pas de citral.
- le produit est un mélange d'au moins 5 corps différents.
- le rapport frontal du menthol est voisin de 0,4
.
vrai figure de droite dans P aucune tache à la même hauteur que C
vrai 5 taches différentes dans P (fig.de droite) donc au moins 5 constituants différents ; parmi ceux ci du menthol, de l'eucalyptol et d'autres non identifiés.
vrai la distance parcourue par le menthol divisée par la distance parcourue par l'éluant est proche de 0,4
saponification d'un corps gras
On saponifie totalement 28,5 g d'un corps gras en utilisant 50 mL de soude de concentration égale à 2 mol L-1.Le corps gras est un triglycéride dont les 3 chaines carbonées sont identiques. Pour doser la quantité de soude en excès, il faut 4 mL d'acide chlorhydrique molaire (1 mol L-1.)
- On a utilisé 0,032 mol de corps gras
- la masse molaire du corps gras est 890 g mol-1.
- la formule brute du coprs gras est C60H104O6.
- la formule développée du corps gras est écrite ci contre.--------->
masse atomique molaire g mol-1 : C=12 ; O=16 ; H=1
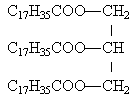
..
au départ, 0,1 mol de soude ; 0,096 mol de soude on réagit avec 0,096 /3 mol de triester
0,032 mol de triglycéride vrai
vrai 28,5 grammes divisé par 0,032 mol donne 890 g mol-1.
faux masse molaire de la formule brute proposée 60*12+104+6*16 =920 g mol-1.
la dernière affirmation est vraie
couples acide base mélange de solutions
On dissout du fluorure d'ammonium dans de l'eau. Les ions fluorure et ammonium se dispersent totalement dans l'eau.
- il n'y a pratiquement aucune réaction entre ces ions et les molécules d'eau.
- Dans une partie de la solution précédente, on verse un peu de soude ; il se produit une réaction totale entre les ions OH- et NH4+.
- Lors du mélange précédent, la quantité d'ion F- diminue.
- .On mélange 30 mL de fluorure d'ammonium à ..0,01 mol L-1 et 20 mL de soude à 0,005 mol L-1 ; Le pH final est 9,2.
..
vrai l' acide le plus fort NH4+ et la base la plus forte OH- sont mis en présence, et l'écart des pKa est voisin de 4,8 ; la réaction entre ces ions est totale.
faux la réaction précédente conduit à la formation de NH3, une base et à la disparition d'une partie des ions ammonium. Le pH augmente donc. Or à pH lus élevé , la base F- conjuguée de l'acide HF prédomine de plus en plus.
faux on obtient une solution telle que les concentrations de l'ion ammonium et de l'ammoniaque NH3 , la base conjuguée sont différentes. Le pH est différent du pKa du couple NH4+ / NH3. (inférieur car l'ion ammonium, l'acide conjugué prédomine)
retour - menu