CHIMIE
:concours kiné 99 Grenoble quelques
exercices
physique
:concours kiné 99
Grenoble
|
|
|
|
exercice
1
|
solution d'hydroxyde
de sodium
|
|
|
|
On dissout 2 mg d'hydroxyde de sodium solide dans 500 mL
d'eau à 25°C
masse atomique molaire gmol-1 Na=23 O=16
H=1
Le pH de la solution obtenue est de 2 ;
12 ; 8 ; 14 ; 10
|
|
|
|
|
|
|
Qté de matière
d'ion hydroxyde (mol)
|
2 10-3 /40
|
5*10-5
|
|
concentration [OH-]
molL-1
|
5*10-5 /0,5
|
10-4
|
|
[H3O+]*{OH-]=10-14
|
[H3O+]
|
10-10
|
|
pH=-log([H3O+])
|
10
|
|
|
|
|
exercice
2
|
dosage acide fort base
forte
|
|
|
On dose 20 ml d'une solution d'acide chlorhydrique par la
soude à0,01 molL-1 en présence de
BBT. Le virage de l'indicateur se produit pour un volume de
base de 9 mL .
La concentration initiale de l'acide est:
90 mmolL-1 ; 4,5
mmolL-1 ; 4,5 molL-1
|
|
|
|
|
|
|
Qté de matière d'ion hydroxyde
(mol)
|
0,01*910-3
|
910-5
|
|
à
l'équivalence qté de matière
d'ion hydronium (mol)
|
910-5
|
|
|
concentration de l'acide molL-1
|
910-5/20 10-3
|
4,5
10-3
|
|
|
exercice
3
|
dosage acide faible
base forte demi
équivalence
|
|
|
A 100 mL dacide éthanoique à 0,1
molL-1, on ajoute 100 mL de soude à 0,005
molL-1. On obtient 200 mL de solution dont le pH
est: 7; 4,75 ; 1,17 ; 1,2 ; 12
pKa(ac éthanoique/ ion
éthanoate)=4,75
|
|
|
|
|
|
|
Qté de matière d'ion hydroxyde
(mol)
|
0.1*0,05
|
5 10-3
|
|
Qté de matière d'acide
éthanoique (mol)
|
0,1*0,1
|
0,01
|
|
arrèt à la demi
équivalence du dosage acide faible base
forte
|
pH=pKa=4,75
|
|
|
|
|
exercice
4
|
constante d'une
réaction acide base
|
|
|
Un litre de solution d'engrais pour plante est
préparé en dissolvant 0,1 mol de phosphate
d'ammonium solide (NH4)3PO4
dans la quantité d'eau nécessaire. La
consatnte de réaction entre les ion ammonium et
phosphate est:1580 ; 3,2 ; 1,72 ; 1,58
10-3
pKa(NH4+/NH3
)=9,2 ;
pKa(HPO42-/PO43-)=12,4
|
|
|
|
|
|
|
l'ion ammonium, acide le plus fort réagit
avec l'ion phosphate, la base la plus forte
|
|
donc la constante de
cette réaction naturelle est assez
grande
|
|
|
|
10-9,2 / 10-12,4
|
103,2=1585
|
|
|
|
|
|
exercice
5
|
trouver la formule
brute d'un ester
|
|
|
L'analyse d'un ester conduit aux pourcentages massiques
suivants: 58,8% de carbone 31,4% d'oxygène et 9,8%
d'hydrogène .Masse atomique molaire en g
mol-1 C=12 ; O=16 ; H=1
La masse molaire de l'ester est: 90 ; 51
; 102 ; 120 ; 142
|
|
|
|
|
|
|
formule brute d'un ester
CnH2nO2
|
|
|
|
n=5
|
102
|
|
|
|
|
|
|
|
exercice
6
|
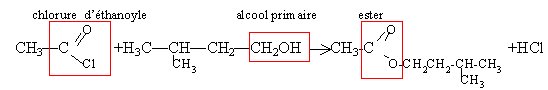
chlorure d'acyle +
alcool --->
ester +
HCl
|
|
|
Le chlorure d'éthanoyle réagit sur le
3-méthylbutane-1-ol en donnant un corps X et du
chlorure d'hydrogène. La masse du chlorure
d'éthanoyle ayant réagi est de 31,4 g. La
masse du produit X formé est (g)
:88,5 ; 78,5 ; 131 ; 52 ; 108
Masse atomique molaire en g mol-1 C=12 ; O=16
; H=1 ;Cl=35,5
|
|
|
|
|
|

|
|
|
|
Qté de matière chlorure d'acyle
(mol)
|
31,4 / 78,5
|
0,4
|
|
X est l'éthanoate de 3-méthylbutane
C7H14O2
|
0,4*130
|
52g
|
|
|
|
exercice
7
|
masse volumique d'un
gaz
|
|
|
On remplit une bouteille plastique de 1,5 L de
dihydrogène. Dans les conditions de
l'expérience le volume molaire d'un gaz est 24
Lmol-1. La masse volumique en gL-1 du
dihydrogène est dans ces conditions égale
à: 4,12 10-2 ; 8,33
10-3 ; 1,33 ; 0,67 ; 1,75
|
|
|
|
|
|
|
Qté de matière de dihydrogène
en mol
|
1,5 / 24
|
0,0625
|
|
masse de dihydrogène en g
|
0,0625*2
|
0,125
|
|
masse volumique g/L
|
0,125 /1,5
|
0,0833
|
|
|
|
exercice
8
|
combustion du butane
réactif en excès
|
|
|
On mélange 5,8 g de butane et 10 L de
dioxygène . La combustion complète de ce
mélange donne du dioxyde de carbone et de l'eau. La
masse d'eau liquide produite est (g) 4,5 ; 9
; 5,4 ; 5,8 ; 11
volume molaire 25Lmol-1 Masse atomique molaire
en g mol-1 C=12 ; O=16 ; H=1
|
|
|
|
|
|
|
C4H10
+6,5 O2
donne 4
CO2 +5
H2O
|
|
|
Qté de matière de butane en
mol
|
5,8 /58
|
0,1
|
|
Qté de matière dioxygène en
mol
|
10 / 25
|
0,4
|
|
à partir de 0,1 mol de
butane il faut 0,65 mol dioxygène
|
excès
butane
|
|
|
à partir de 0,4 mol dioxygène il se
forme 0,4*5 /6,5 mol d'eau
|
0,307*18
|
5,4
g
|
|
|
|
exercice
9
|
pourcentage massique
et densité
|
|
|
On dispose d'une bouteille de 0,5 L d'une solution
commerciale d'acide nitrique . L'étiquette de la
bouteille porte les indications suivantes : densité
1,33 pourcentage massique en acide 52,5%. La concentration
molaire de la solution commerciale est: 2,2
10-2 ; 8,33 ; 5,54 ; 11,08 ; 16
acide nitrique HNO3
Masse atomique molaire en g mol-1 N=14 ;
O=16 ; H=1
|
|
|
|
|
|
|
masse d'acide dans 1 litre
|
0,525*1330
|
698 g
|
|
Qté de matière d'acide dans un
litre
|
698 / 63
|
11,08 mol
|
|
concentratin de l'acide molL-1
|
11,08
|
|
|
1 litre de solution de
densité 1,33 a une masse de 1330
grammes
|
|
|
|
exercice
10
|
acide chlorhydrique et
alliage nickel cuivre
|
|
|
Un alliage nickel cuivre est attaqué à
froid par de l'acide chlorhydrique en excès . la
masse de l'alliage est 3 g . On recueille 427,4 ml de
dihydrogène dans les conditions normales de
tempèrature et de pression . On donne les potentiels
redox Ni2+/Ni -0,23 V ; Cu2+/Cu 0,34V
; H+/H2... 0V. La masse en gramme de
résidu solide après réaction est :
0 ; 4,7 ; 4,88 ; 1,79 ; 1,88
Masse atomique molaire en g mol-1 Ni=58,7 ;
O=63,5
|
|
|
|
|
|
|
Ni + 2H3O+ donne H2
+ Ni2+ + 2 H2O
|
cuivre non
attaqué
|
|
Qté de matière de dihydrogène
en mol
|
0,4274 / 22,4
|
0,0191
|
|
Qté de matière de nickel
attaqué en mol
|
|
0,0191
|
|
masse de nickel attaqué en g
|
0,0191*58,7
|
1,12 g
|
|
le résidu est
le cuivre
|
3-1,12
|
1,88
g
|
|
|
|
exercice
11
|
variation de masse des
électrodes d'une pile
|
|
|
Les demi-équations électroniques qui se
produisent aux électrodes d'une pile sont: Cr donne
Cr3+ +3e- Pb2+ +
2e- donne Pb. La perte de masse de
l'électrode en chrome est 1,56 g . La masse de plomb
déposée à l'autre électrode est:
(g): 9,32 ; 6,24 ; 1,56 ; 18,71 ;
3,12
Masse atomique molaire en g mol-1 Cr=52 ;
Pb=207,2
|
|
|
|
|
|
|
3
Pb2+ +2
Cr donne 3 Pb
+ 2
Cr3+
|
|
|
|
Qté de matière de chrome perdue en
mol
|
1,56/52
|
0,03
|
|
Qté de matière de plomb gagnée
en mol
|
0,03 /2 *3
|
0,045
|
|
masse de plomb déposée en
grapmme
|
0,045*207,2
|
9,32
|
|
|
|
|
|
|
|
|
|
exercice
12
|
argenter une plaque
métallique par électrolyse
|
|
|
L'une des 2 électrodes est constituée par
l'objet métallique . L'électrolyte est une
solution de sulfate d'argent(I) . La surface à
argenter est 0,25 m2, l'épaisseur de la
couche à déposer est égale à
0,015 mm . La masse volumique de l'argent est
10500kgm3 . L'intensité du courant qui
traverse l'électrolyseur est 60A . masse atomique
molaire gmol-1 Ag=108 un faraday = 96500 coulombs
. La durée de l'électrolyse pour
éffectuer ce dépot est: 9
min47s ; 84,6 h ; 304,6 min ; 84,6 min ; 15 min
|
|
|
|
|
|
|
volume d'argent (m3)
|
0,25*1,5 10-5
|
3,75 10-6
|
|
masse d'argent ( kg)
|
3,75 10-6*10500
|
0,03937
|
|
Qté de matière d'argent en
mol
|
0,03937*1000/108
|
0,3645
|
|
Qté de matière d'électrons
(mol)
|
0,3645
|
|
|
la charge d'une mole
d'électrons est 96500 coulombs
|
0,3645*96500
|
35182 C
|
|
durée (s) * intensité
(A)=35182
|
durée
586,3s
|
9 min
47s
|
|
|
|
exercice
13
|
pluies
acides
|
|
|
Une installation de chauffage utilise 3600 L de fuel
(densité 0,9) par an contenant en masse 0,3% de
soufre . Elle rejette du dioxyde de soufre dans
l'atmosphère . Ce dernier se transforme en acide
sulfurique 2S
+3O2
+2H2O
donne 2
H2SO4 . La masse (kg) d'acide
sulfurique formée annuellement est
992,7 ; 29,8 ; 59,6 ; 14,9 ; 2980
masse atomique molaire gmol-1 S=32 ; O=16
; H=1
|
|
|
|
|
|
|
masse de fuel (kg)
|
3600*0,9
|
3240
|
|
masse de soufre (kg)
|
3240*0,3/100
|
9,72
|
|
Qté de matiére de soufre
(mol)
|
9720 / 32
|
303,7
|
|
Qté de matière acide sulfurique
(mol)
|
303,7
|
|
|
mased'acide sulfurique (kg)
|
303,7*(2+32+48)
|
29,76
|
|
|
|
exercice
14
|
oxydation par le
permanganate de potassium
|
|
|
On dose en milieu acide 20 mL d'une solution de fer(II)
par une solution de permanganate de potassium à 1,8
10-2 molL-1 . Il faut verser 14,6 mL
de cette solution pour observer une coloration rose
persistante. MnO4- + 8H+ +
5 e- donne
Mn2+ + 4H2O et Fe2+ donne
Fe3+ +
1e- . La
concentration en ion fer (II) est en molL-1 :
0,12 ; 0,013 ; 0,025
; 0,018 ; 6,6 10-2
|
|
|
|
|
|
|
MnO4- + 8H+ +
5
Fe2+
donne
5
Fe3++ Mn2+ +
4H2O
|
|
|
Qté de matière d'ion permanganate
(mol)
|
0,0146*0,018
|
2,628 10-4
|
|
Qté de matière d'ion fer(II)
mol
|
5*2,628
10-4
|
1,314 10-3
|
|
concentration d'ion fer (II)
molL-1
|
1,314 10-3 / 0,02
|
0,0657
|
retour
- menu
|

