. .
les dix exercices suivants
|
|
|
|
Qté de matière (mol) = volume (L)/ volume molaire ( L/mol)
titre massique = concentration volumique* masse molaire


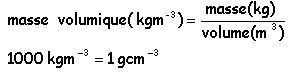
d densité par rapport à l'eau (solide ou liquide)
d=1,8 signifie un litre de ce liquide a une masse de 1,8 kg
concentration molaire en soluté apportée (mol/L) :
|
|
volume de la solution (L) |
concentration effective d'un ion (mol/L) :
soit le solide ionique de formule An Bm dissout dans l'eau. L'édifice cristallin est détruit lors de la dissolution ; les ions sont hydratés ( entourés de molécules d'eau) et se dispersent au sein de la solution.
An Bp --> n A a+ + p Bb- avec a n = b p
La concentration effective du cation est notée : [A a+ (aq)]= n * concentration molaire en soluté apporté = n c0.
La concentration effective de l'anion est notée : [B b- (aq)]= p * concentration molaire en soluté apporté = p c0.
La solution étant électriquement neutre : a[A a+ (aq)] = b[B b- (aq)]
dilution
diluer 10 fois c'est ajouter de l'eau à une solution jusqu'à ce que le volume final soit 10 fois plus grand que le volume de départ. La concentration est alors divisée par 10.
il faut prélever à la pipette un volume v de la solution mère
les placer dans une fiole jaugée, compléter avec de l'eau distillée.
volume pipette (L)* [sol. mère] (mol L-1) =volume fiole jaugée (L)* [sol. finale] (mol L-1)
Le facteur de dilution, noté F, nombre supérieur à 1, vaut :
concentration solution fille
volume solution mère
|
|
Une masse m=17,1 g de sulfate d'aluminium solide est dissoute dans V=250 mL d'eau. Al=27; S=32 ;O=16 gmol-1.
|
corrigé
titre en sulfate d'aluminium
volume de la solution (L)
0,25
Concentration en soluté apporté du sulfate d'aluminium :
Al2(SO4)3
donne
2Al3+
et
3SO42-
Masse molaire M (g /mol)
342
concentration effective en ion sulfate 3 *0,2=0,6 mol L-1.
concentration effective en ion aluminium2*0,2=0,4 mol L-1.
La solution demeure électriquement neutre
3[Al3+]=2[SO42-]
d'autre données m=17,1 et V=100 .......réponses:0,5 ; 171 ; 1,5 ; 1
m=10 et V=250 ..........réponses:0,117 ; 40 ; 0,351 ;0,234
Une solution de sulfate de zinc est obtenue en dissolvant m =32,3 g de sulfate de zinc solide dans V=250 mL d'eau. on donne Zn=65,4 ; O=16 ; S=32 g mol-1.
- Quelle est la masse molaire du sulfate de zinc?
- Quels sont le titre et la concentration en soluté apportéd u sulfate de zinc ?
- Quels sont les concentrations effectives des ions Zn2+ et SO42-?
- Vérifier que la solution est électriquement neutre.
corrigé
titre en sulfate de zinc
volume de la solution (L)
0,25
Concentration en soluté apporté du sulfate de zinc :
ZnSO4.
donne
1Zn2+
et
1SO42-
Masse molaire M (g /mol)
161,4
concentration effective en ion sulfate 1 *0,8=0,8 mol L-1.
concentration effective en ion aluminium1*0,8=0,8 mol L-1.
La solution demeure électriquement neutre
2[Zn2+]=2[SO42-]
d'autre données m=32,3 et V=100 .......réponses:2 ; 1323 ; 2 ; 2
m=8,07 et V=250 ..........réponses:0,2 ; 32,28 ; 0,2 ;0,2
|
|
- Quelles ont les concentrations effectives des ions présents en solution après mélange.
- Vérifier que la solution est électriquement neutre.
corrigé
|
|
|
|
|
|
|
0,1*0,8=0,08 issu de la seconde solution |
|
0,1*0,8=0,08 issu de la seconde solution total =0,14 |
|
|
|||
|
|
|
|
|
2[Zn2+] +3[Al3+]=2[SO42-]
d'autre
données V1=50
;V2=100 ;C1=0,5 et C2=2
.......réponses:1,33
;0,333 ; 1,83
V1=200 ;V2=100 ;C1=0,117 et C2=0,2 .......réponses: 0,156 ; 0,067 ; 0,3
On veut préparer 500 mL d'une solution A aqueuse de permanganate de potassium de concentration molaire en soluté apporté c=2,0 10-2 mol/L à partir de cristaux de permanganate de potassium KMnO4(s).
- Quelle masse de critaux faut il utiliser ?
- Donner la concentration en ions permanganate dans la
solution A puis dans le volume v = 10 mL.
- Calculer la quantité d'ions permanganate présente dans ce volume v. - On ajoute 10 mL d'eau distillée aux 10 mL de
la solution A ; soit B la solution obtenue. Calculer la
quantité d'ions permanganate présente dans
la solution B.
- Donner la concentration en ions permanganate dans la solution B.
Données : masse atomique molaire (g/mol) K : 39,1 ; Mn : 54,9 ; O : 16.
corrigé
Masse de cristaux à peser :
Masse molaire KMnO4 : M= 39,1+54,9+4*16 = 158 g/mol.
Quantité de matière KMnO4 dans 0,5 L : concentration ( mo/L) * volume (L) = 0,02*0,5 = 0,01 mol
masse de cristaux à peser (g) : quantité de matière (mol) * masse molaire (g/mol)
m= 0,01*158 = 15,8 g ( 1,6 g : deux chiffres significatifs)
Concentration en ions permanganate dans la solution A puis dans le volume v = 10 mL :
KMnO4(s) = K+(aq) + MnO4-(aq)
la concentration effective de chaque ion est égale à la concentration en soluté apporté
[K+(aq)]=[MnO4-(aq)]=c=2,0 10-2 mol/L dans la solution A et dans le volume v.
Quantité de matière d'ion permanganate dans le volume v : 10 mL = 0,01 L
concentration (mol/L) * volume (L) = 0,02*0,01 = 2,0 10-4 mol.
Concentration en ions permanganate dans la solution B :
quantité de matière d'ion permanganate : 2 10-4 mol
volume de la solution B : 10 +10 = 20 mL = 0,02 L
[MnO4-(aq)]B= 2 10-4 /0,02 = 1,0 10-2 mol/L.
nitrate de cuivre Cu(NO3)2 et potasse KOH
On ajoute à une solution de nitrate de cuivre (Cu2+ ; 2 NO3-) un volume V de potasse ( K+ ; HO-) telle que [HO-]= 1 mol/L. On observe la formation d'un solide bleu, l'hydroxyde de cuivre II Cu(OH)2. La masse de ce solide vaut m= 2,0 g.
Cu2+ + 2 HO- = Cu(OH)2.
Quel est le volume de potasse ajouté ? Cu : 63,5 ; H : 1,0 ; O : 16 g/mol.
corrigé
Quantité de matière d'hydroxyde de cuivre II :
masse molaire Cu(OH)2 : M= 63,5+2*(16+1) = 97,5 g/mol
Quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 2 / 97,5 = 0,0205 mol
Quantité de matière de potasse :
D'après les coefficients stoechiomètriques de l'équation Cu2+ + 2 HO- = Cu(OH)2, la quantité de matière d'ion hydroxyde est égale à 2 fois la quantité de matière d'hydroxyde de cuivre II : n( HO-) = 2*0,0205 = 0,041 mol ; n(potasse) = 0,041 mol.
Volume de potasse :
concentration (mol/L) = Quantité de matière (mol) / volume de la solution ( L)
d'où volume V= Quantité de matière (mol) /concentration (mol/L) = 0,041 / 1 = 0,041 L = 41 mL.
nitrate d'argent AgNO3 et chlorure de magnésium MgCl2
les ions argent et chlorure sont incompatibles en solution ; ils conduisent à un solide blanc le chlorure d'argent AgCl
Ag+ + Cl- donne AgCl solide
Danger!! dans le chlorure de magnésium, il y a deux ions chlorures pour un ion magnésium
- Quelles ont les concentrations des ions présents en solution après mélange et réaction chimique.
- Vérifier que la solution est électriquement neutre.
corrigé
|
|
|
|
|
|
|
|
0,1*10=1 |
1 mmol disparaît bilan : 0 |
1 mmol disparaît bilan : 1 |
|
|
|
||||
|
|
|
|
|
|
2[Mg2+] =1[Cl-]+1[NO3-]
d'autre
données V1=20
;V2=10 ;C1=0,1 et C2=0.1
.......réponses:0,033
;0; 0 ;0,067
V1=20 ;V2=10 ;C1=0,2et C2=0,1 .......réponses: 0,033 ; 0,067 ; 0 ; 0,133
|
|
L'étiquette d'une solution commerciale indique :....... volume V=1L ; ammoniaque NH3 ;
pourcentage massique en NH3 :28% ; densité : d=0,95 ; masse molaire 17 gmol-1.
- Quelle est la concentration en soluté apporté de la solution commerciale ?
- On désire préparer par dilution, V1=500mL d 'une solution d'ammoniaque à 0,1 mol L-1. Quel volume de la solution commerciale faut-il prélever?
corrigé
masse d'ammoniaque dans cette solution : 0,28*0,95 =0,266 kg =266g
Quantité de matière d'ammoniaque en mol: 266 / 17 =15,6 mol
La solution finale contient
0,5*0,1
=0,05
mol d'ammoniaque
Ces 0,05 mol ont été prélévé a l'aide d'une pipette de volume V litre
à partir de la solution mére de concentration 15,6 mol L-1.
Quantité de matière d'ammoniaque prélevée : 15,6 V = 0,05
V=0,05 / 15,6=3,2 mL
d'autre données HCl 36,5 gmol-1 ; d=1,18 ; .35%......réponses:11,3 ; 4,4 mL
HNO3 63 gmol-1 ; d=1,33 ; 53% ....réponses:11,2 ; 4,4 7mL
A partir d'une solution de sulfate de nickel NiSO4 de concentration C0=0,2 mol L-1 , on désire préparer V=200 mL de solution diluée telle que C=0,01 mol L-1.
- Quel volume de la solution mère faut-il prélever à la pipette?
corrigé
Ces 0,002 mol ont été prélévé a l'aide d'une pipette de volume V litre
à partir de la solution mére de concentration 0,2 mol L-1.
Quantité de matière de la solution mère prélevée : 0,2 V = 0,002
V=0,002 / 0,2=10 mL
d'autre données C0=0,1 mol L-1 ; C=2 10-3 ; .V=250mL.....réponse: 5 mL
C0=0,5 mol L-1 ; C=5 10-2; .V=100mL.....réponse: 10 mL
On désire préparer V=100 mL d'une solution de chlorure de cuivre (II) CuCl2 de concentration en soluté apporté C=0,1 mol L-1 .
- Quelle masse de chlorure de cuivre anhydre faut il peser? Cu=63,5 ; Cl=35,5 g mol-1.
corrigé
masse molaire du chlorure de cuivre anhydre 63,5+2*35,5=134,5 g mol-1.
masse de chlorure de cuivre solide à peser: 0,01*134,5 = 1,345 g
d'autre données C=0,1 mol L-1 ;.V=250mL.....réponse: 3,36 g
C=0,01 mol L-1; .V=500mL.....réponse: 0,67 g
|
|
|
|
Une solution A de volume 1 00 mL contient les cations Ag+, Pb2+ et Al3+ aux concentrations respectives C1, C2 et C3. Le dispositif expérimental comporte deux filtres mis en série. Sur le premier filtre on a disposé une masse connue de poudre de cuivre et sur le second une masse connue de zinc. La solution A est versée sur le premier filtre. Puis on rince le solide restant ; le filtrat et les eaux de rinçage passent sur le deuxième filtre. On recommence l'opération et on recueille dans le bécher inférieur l'ensemble des solutions. Après séchage des filtres, on constate que la masse du premier a augmenté de m1 = 1,523g et celle du second de m2 = 1,399g. La solution est traitée par NaOH sans excès puis par de l'ammoniaque concentrée. On recueille un précipité de masse m3 = 0,780 g.
corrigé 1er filtre : Cu + 2 Ag+ ---> Cu2+ + 2Ag. 1,523/108= 0,014
mol Ag et
0,007 mol ion Cu2+.
Pb2+ + Zn ---> Zn2+ + Pb. 0,007*63,5= 0,447 g de cuivre donc 1,399-0,117= 0,951 g plomb 0,951/207=0,0046
mol ion
Pb2+.
Al3+ + 3OH- ---> Al(OH)3 solide 0,78/
78= 0,01 mol
ion Al3+
[Ag+]=0,14 molL-1. [Pb2+]=0,046 molL-1. [Al3+]=0,1 molL-1. |
|