. .
|
|
|
|
|
Quantité de chaleur échangée entre le milieu extérieur et le milieu réactionnel dans lequel se déroule cette réaction
énergie de liaison Soit un corps diatomique AB, l'énergie de la liaison AB est l'énergie qu'il faut fournir à une mole de molécules, prises à l'état gazeux, pour les dissocier en leurs atomes constitutifs à l'état gazeux, à une température donnée. chaleur de réaction et énergie de liaison chaleur de réaction = S E liaisons rompues - S E liaisons formées E : énergie de liaisons
chaleur molaire latente de changement d'état chaleur échangée, sous pression constante, avec le milieu extérieur par une mole de ce corps lors du changement d'état. |
|
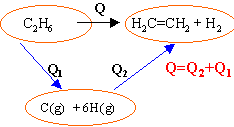
L'éthane est transformé en éthylène et dihydrogène, réactifs et produits sont gazeux.
énergie de liaison
(kJmol-1 ) :H-H :432; C-H : 410 ; C-C:
348 ; C=C :612
|
|
|
|
 |
|
Q2= -(EC=C + 4 EC-H+ EH-H) Q= EC-C + 6 EC-H-(EC=C + 4 EC-H+ EH-H) Q= [ EC-C + 2 EC-H] - [ EC=C + EH-H] S E liaisons rompues -S E liaisons formées Q=348 + 2*410 - 612-432 =
124
kJmol-1.
|
|
|
|
|
|
|
|
C2H6O(l)+3O2(g)---> 3H2O(l) + 2CO2(g)
|
énergie de liaison (kJmol-1 ) : C-O :356; C-H : 410 ; C-C: 348 ; H-O :460; C=O :795; O=O :494 chaleur molaire latente vaporisation (kJmol-1 ) : eau 41 ; éthanol 42,6 |
|
|
|
|
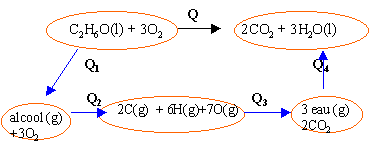
Q1= 42,6 chaleur latente vaporisation éthanol Q4= -3*41 =-123 opposé chaleur latente vaporisation eau Q2= EC-C + 5 EC-H + EO-H+ EC-O+ 3EO=O Q3= -[ 4EC=O + 6 EO-H ] Q = Q1+ Q2+ Q3+ Q4 Q = 42,6- 123 + [EC-C + 5 EC-H + EO-H+ EC-O+ 3EO=O]-[ 4EC=O + 6 EO-H ] Q=-80,4+S E liaisons rompues -S E liaisons formées Q=-80,4 +348 +5*410 +460 +356 +3*494 -4*795 -6*460 = -1324 kJmol-1. réaction
exothermique
1324/46*1000=28782 kJ kg-1. |
|
C6H12O6(s)+6O2(g)---> 6H2O(l) + 6CO2(g) ...Q (1)
|
6C(s)+6H2(g)+3O2(g) --->C6H12O6(s) Q1=-1260 kJmol-1 (2) C(s)+O2(g)--->CO2 (g) Q2= -393 kJmol-1 (3) H2(g)+0,5 O2(g)--->H2O(l) Q3= -282 kJmol-1 (4) |
|
|
corrigé |
|
|
C6H12O6(s)--->6C(s)+6H2(g)+3O2(g) 1260 kJmol-1 6 fois [C(s)+O2(g)--->CO2 (g)] 6*(-393) kJmol-1 6 fois [ H2(g)+0,5 O2(g)--->H2O(l)] 6*(-282) kJmol-1 Q=1260
-2358-1692=
-2790 kJmol-1
2790*1000/180= 15500 kJ kg-1. valeur énergétique chaleur que dégage la combustion complète de 1g de glucose 2790/180=15,5 kJ g-1. |
|
|
|