En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
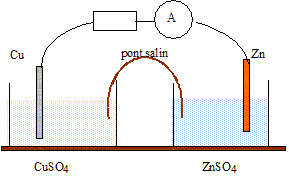
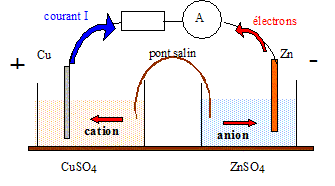
Texte : Zn/Zn2+(aq)//Cu2+(aq)/Cu.
Volume de chaque solution : V= 0,05 L ( 50 mL) ; concentration de chaque solution : C = 0,010 mol/L. Masse de chaque électrode : 3 g Masse atomique molaire : Zn : 65,4 ; Cu : 63,5 g/mol. Analyse : Questions traitant du sens de circulation des porteurs de charges. Electrons dans les conducteurs métalliques et ions dans les solutions et le pont salin. Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn = Zn2+ +2e-.
Questions traitant des mots " anode, cathode, oxydation, réduction". Le zinc, métal plus réducteur que le cuivre, s'oxyde : Zn = Zn2+ +2e-. Le zinc subit une oxydation ; le zinc constitue l'anode négative. Les ions Cu2+ se réduisent : Cu2+ +2e- = Cu. Les ions cuivre (II) subissent une réduction ; le cuivre constitue la cathode positive.
Cu2+aq
+Zns = Zn2+ aq +
Cus.
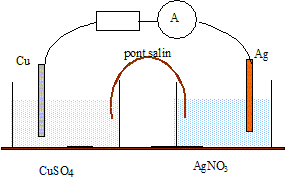
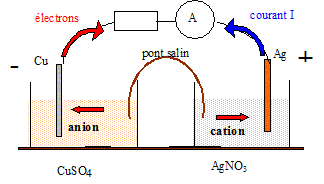
Pile cuivre argent.
Texte : volume de de chaque solution V = 0,1 L ( 100 mL) ; concentrations [Ag+]=c1 =0,02 mol/L, de concentration [Cu2+]=c2 =0,10 mol/L. Les métaux sont en excès. Analyse : Questions traitant du sens de circulation des porteurs de charges. Electrons dans les conducteurs métalliques et ions dans les solutions et le pont salin. Le cuivre, métal plus réducteur que le l'argent, s'oxyde : Cu = Cu2+ +2e-.
Questions traitant des mots " anode, cathode, oxydation, réduction". Le cuivre, métal plus réducteur que le l'argent, s'oxyde : Cu = Cu2+ +2e-. Le cuivre subit une oxydation ; le cuivre constitue l'anode négative. Les ions Ag+ se réduisent : 2Ag+ +2e- = 2Ag. Les ions argent (I) subissent une réduction ; l'argent constitue la cathode positive. D'où la réaction de fonctionnement de la pile : 2 Ag+aq +Cus = Cu2+ aq + 2 Ags. Question traitant du " sens d'évolution ". Qr i = [Cu2+]i / [Ag+]i2 = 0,1/ 0,022 = 250 Qr i < K donc évolution spontanée dans le sens direct.
Questions traitant de la concentration finale des ions. Quantités de matière initiales des ions : concentration (mol/L) * volume (L) pour les ions. n(Cu2+) =c2V =0,1*0,1 = 10-2 mol ; n(Ag+) =c1V = 0,02*0,1 = 2 10-3 mol
Hypothèse faite : xéq voisin de xmax voisin de 10-3 mol d'où : [Cu2+]éq = (10-2 + 10-3 ) / 0,1 = 0,11 mol/L. [Ag+]éq = ( 0,11 /2 1015 )½ = 7,4 10-9 mol. L'hypothèse est-elle vérifiée ? xéq = [Ag+]éq V = 7,4 10-9*0,1 = 7,4 10-10. réponse : hypothèse valide. Les affirmations contenant l'une des informations ci-dessus sont donc exactes.
Pile : Zn(s)/ Zn2+ (aq) // Pb2+ (aq) / Pb (s) Texte : volume de chaque solution V = 100 mL ; concentrations [Zn2+] = 2,5 .10-2 mol/L, [Pb2+] = 5,0.10-3 mol.l-1 ; les métaux, plomb et zinc des électrodes sont en excès. La borne COM du voltmètre est reliée au plomb, la borne V est reliée au zinc. Données : Zn2+ aq+ Pb s = Zn s + Pb2+ aq; K =2.10-21. Analyse : Questions traitant de la réaction de la pile. Il s'agit d'une transformation spontanée ; la constante de la réaction est élevée. Zn2+ aq+ Pb s = Zn s + Pb2+ aq; K =2.10-21 ne peut pas convenir. Par contre : Zn s + Pb2+ aq = Zn2+ aq+ Pb s ; K' = 1/K = 5 1020 convient. Le zinc s'oxyde : Zn(s) = Zn2+ +
2e- et constitue la borne négative ( qu'il
faut relié au COM du voltmètre pour lire une
valeur positive) à l'intérieur des solutions et du pont
salin, les ions se déplacent La pile s'arrête de fonctionner : lorsque l'un au moins des réactifs a pratiquement disparu, ici Pb2+ ( car Zn, plaque épaisse en excès) lorsque le quotient de réaction est égal
à la constante d'équilibre.
2,5 10-3 + xéq proche de 2,5 10-3 +5 10-4 = 3 10-3 mol ; [Zn2+]éq = 3 10-3 /0,1 = 0,03 mol/L [Zn2+]éq / Pb2+]éq= 2 1020 conduit à : Pb2+]éq= 0,03 / 2 1020 = 1,5 10-22 mol/L. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|