Le diabète
Exercice 1 : Dépistage et traitement du diabète (10 points)
Dans le cadre du dépistage d’un diabète, un patient se voit prescrire
une analyse de sang pour déterminer la concentration de glucose (aussi
appelée glycémie) lorsqu’il est à jeun.
Une des techniques de dosage repose sur une méthode
spectrophotométrique.
Cette méthode utilise un réactif qui contient de l’ortho-dianisidine et
deux enzymes, dont l’action sur le glucose après chauffage forme un
produit coloré. Un dosage spectrophotométrique peut donc être effectué.
On prépare avec cette méthode, une solution mère S
0 de
concentration initiale en masse de glucose égale à 0,50 g∙L
-1.
Des solutions étalons de volume V = 25 mL sont obtenues par dilution de
cette solution mère.
On mesure leur absorbance A à une longueur d’onde appropriée.
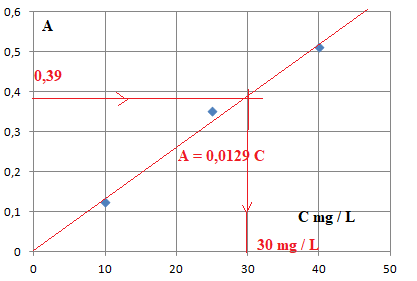
S
1 : 10 mg/ L ; A = 0,125.
S
2 : 25 mg / L ; A = 0,352.
S
3 : 40 mg / L ; A = 0,512.
On souhaite préparer la solution S
3 à partir de la solution
mère S
0.
1. Calculer le
volume de solution mère S
0 à prélever.
Facteur de dilution : 500 / 40 = 12,5.
Volume de solution mère à prélever : 25 / 12,5 = 2,0 mL.
2. À partir du
matériel disponible listé ci-dessous, choisir le matériel adapté pour
préparer la solution S
3.
Pipette jaugée de 2,0 mL et fiole jaugée de 25,0 mL.
3. Tracer la courbe
d’étalonnage représentant l’absorbance A des solutions étalons en
fonction de leur concentration en masse C de glucose.
 4.
4. À partir de la
courbe d’étalonnage, conclure sur la relation entre l’absorbance A de
la solution de glucose et la concentration en masse de glucose.
Absorbance et concentration sont proportionnelles.
En appliquant le même protocole, on mesure l’absorbance de
l’échantillon de sang dilué 50 fois : A sang dilué = 0,39.
5. Déterminer la
concentration en masse en glucose Csang dilué dans l’échantillon de
sang dilué.
C = 0,39 / 0,0129 ~30 mg / L.
6. En déduire que la
concentration en masse en glucose Csang dans l’échantillon de sang
prélevé est proche de 1,5 g∙L
-1. Conclure quant à la
glycémie à jeun de ce patient.
30 x 50 = 1500 mg /L = 1,,5 g / L.
Cette valeur est supérieure à 1,10 g / L : hyperglycémie.
7. Définir un
nanomédicament et préciser l’ordre de grandeur de ses dimensions.
Association d'un principe actif avec un nanovecteur.Taille : de 1 à 100
nm.
8. Développer les
avancées que constitue l’usage de nanomédicaments dans le traitement du
diabète.
Leur taille est proche de nombreuses substances biologiques. Les
interactions entre nanomédicaments et substances biologiques sont
favorisées.