La spiruline
Exercice 1 : (10 points)
1. Justifier que la valine et l’histidine sont des acides
a-aminés.
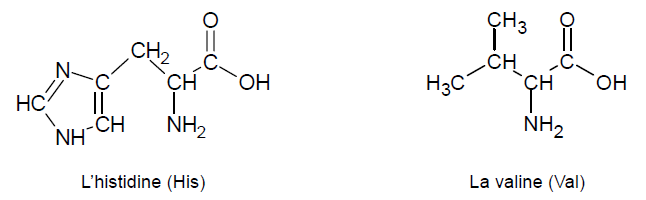
La fonction acide carboxylique COOH et la fonction amine NH
2 sont portées par le même atome de carbone.
2. La valine et l’histidine peuvent se combiner pour former des dipeptides. Nommer le type de réaction qui conduit à un dipeptide.
Condensation de la fonction acide carboxylique de l'hysidine et de la fonction amine de la valine par exemple.
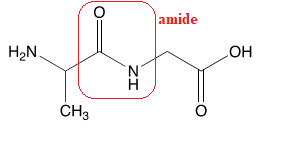
3. Nommer et représenter la liaison caractéristique des dipeptides.
Par exemple :
 4.
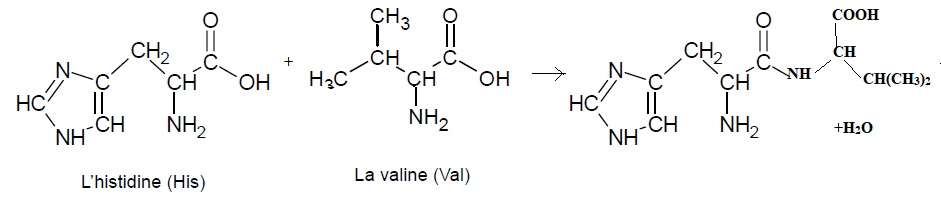
4. Écrire l’équation de la réaction qui permet d’obtenir le dipeptide His-Val à partir des molécules d’histidine et de valine.
 5.
5. Nommer toutes
les combinaisons possibles de dipeptides issus des réactions pouvant se
produire dans un mélange de valine et d’histidine.
His - His ; His - Val ; Val - Val ; Val - His.
6. Définir la DJA (Dose Journalière Admissible) d’une substance.
Quantité d'une substance qu'un individu peut ingérer chaque jour sans conséquence pour sa santé.
7. D’après un site
marchand, il serait conseillé de consommer 3 grammes de spiruline par
jour, tous les jours. Vérifier que la masse de cuivre apportée par
cette consommation est d’environ 3,8 μg.
100 g de spiruline apporte 0,126 mg = 126 µg de cuivre.
126 x3 / 100 ~3,8 µg.
8. Indiquer si la consommation de 3 g de spiruline par une personne de 63 kg ne dépasse pas la DJA du cuivre. (70 µg kg
-1 jour
-1).
3,8 / 70 =0,054
µg kg-1 jour-1.
Cette valeur est inférieure à la DJA du cuivre.