La
pollution d’une eau peut être due à différentes espèces chimiques. La
pollution au phosphore est souvent sous-estimée mais peut être la cause
d’une prolifération d’algues vertes, et réduire l’efficacité des
produits de traitement, ce qui pose un problème, notamment dans les
bassins de piscine.
Le phosphore existe sous diverses formes : PO
43–, HPO
42–, H
2PO
4– et H
3PO
4. Par souci de simplification, nous appellerons ces espèces « espèces phosphorées ».
L’objectif de cet exercice est d’effectuer un contrôle qualité de l’eau
d’une piscine pour savoir s’il y a un risque de prolifération d’algues.
Données :
- couples acide-base des espèces phosphorées accompagnées de leur valeur de pKa :
H3PO4 (aq) /
H2PO4– (aq) pKa1 = 2,1 ;
H2PO4– (aq) /
HPO42– (aq) pKa2 ;
HPO42– (aq) /
PO43– (aq) pKa3.
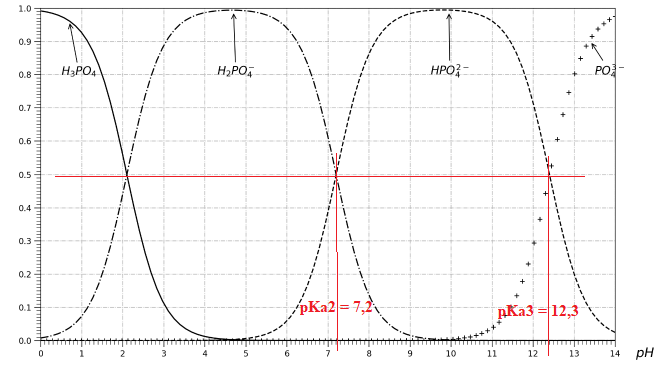
Le diagramme de distribution des couples acide-base des espèces phosphorées est représenté.
Q1. À l’aide de la figure , déterminer la valeur du pKa2 et la valeur du pKa3.
 Q2.
Q2. Représenter le
diagramme de prédominance de ces espèces phosphorées. En déduire la
nature de l’espèce phosphorée majoritaire dans l’eau d’une piscine dont
le pH vaut 7,0.
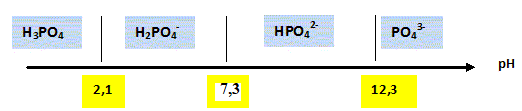
A pH=7, H
2PO
4- prédomine.
Les espèces phosphorées sont incolores. Dans l’objectif de réaliser un
dosage spectrophotométrique, il est donc nécessaire d’ajouter à la
solution un réactif spécifique qui permettra de former un composé
coloré.
Le spectre d’absorbance du composé coloré ainsi que le cercle chromatique sont donnés .
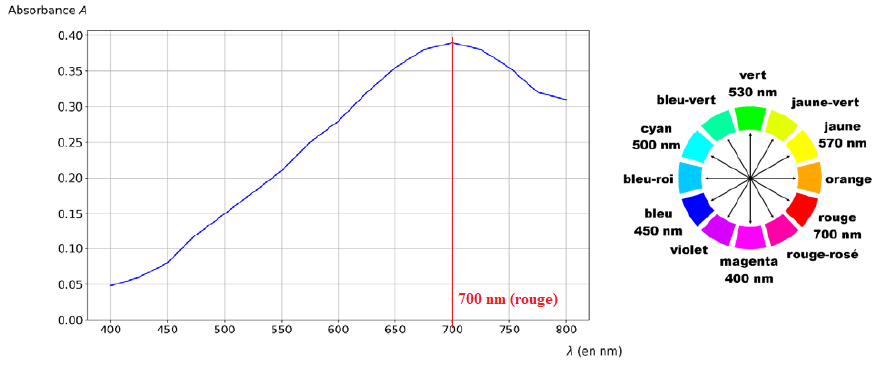 Q3.
Q3. À l’aide de la figure et en expliquant votre démarche, proposer une valeur de longueur d’onde
l
à laquelle il serait judicieux de régler le spectrophotomètre.
Préciser, en justifiant, la couleur du composé coloré formé après ajout
du réactif.
Pour un maximum de précision on se place à la longueur d'onde correspondant au maximum d'absorption.
La solution possède la couleur complémentaire du rouge soit le cyan.
Dans l’objectif de préparer une gamme étalon, on cherche, dans un premier temps, à fabriquer une solution S
0 de concentration en quantité de matière en espèce phosphorée C(S
0) = 3,67×10
–3 mol·L
–1.
Le solide utilisé pour la dissolution est le dihydrogénophosphate de potassium de formule brute KH
2PO
4.
On considére alors que tout le solide se dissout et que la quantité de
matière en espèce phosphorée dissoute est égale à la quantité de
matière de solide introduite.
Donnée :
- masse molaire du dihydrogénophosphate de potassium solide : M(KH
2PO
4) =M= 136 g∙mol
–1.
Q4. Montrer que la masse m qu’il faut prélever pour préparer la solution S
0 dans une fiole jaugée de volume V = 200 mL est voisine de 100 mg.
Quantité de matière n =
C(S0) V = 3,67 10-3 x0,200=7,34 10-4 mol.
m = n M=7,34 10-4 x 136 ~0,100 g ou 100 mg.
Les concentrations en masse en espèces phosphorées présentes dans l’eau
de piscine sont relativement faibles (de l’ordre de 0,05 à 1,00 mg par
litre de solution). C’est pourquoi il est nécessaire de diluer au
préalable cette solution S
0 cent fois pour obtenir une solution notée S.
Q5. Écrire en le détaillant, le protocole de la préparation de la solution S à partir de la solution S
0. Préciser la verrerie utilisée ainsi que son volume.
Facteur de dilution F = 100.
Prélever 200 / 100 = 2,0 mL de solution S
0 à l'aide d'une pipette jaugée de 2,0 mL.
Verser dans la fiole jaugée de 200 mL contenant 1/3 d'eau distillée. Agiter.
Comléter jusqu'au trait de jauge à l'aide d'eau distillée. Agiter pour rendre homogène.
Une gamme étalon est enfin effectuée à partir de la solution S en suivant le protocole suivant :
- on prélève un volume de solution S selon les conditions résumées dans
le tableau ci-dessous et on l’insère dans une fiole jaugée de 25,0 mL ;
- un volume de 5,00 mL de réactif spécifique permettant la formation du complexe coloré est ajouté dans chaque fiole ;
- chaque solution est complétée avec de l’eau distillée jusqu’au trait
de jauge de la fiole jaugée qui est ensuite bouchée et agitée ;
- l’absorbance de chaque solution de la gamme étalon est alors mesurée.
Solution de volume total 25 mL
|
S0
|
S1
|
S2
|
S3
|
S4
|
Volume de solution S ( mL)
|
0
|
2,50
|
5,00
|
7,50
|
10,0
|
Concentration C (mg/L) en espèce phosphorée
|
0
|
0,50
|
1,00
|
1,50
|
2,00
|
Absorbance
|
0
|
0,080
|
0,162
|
0,231
|
0,311
|
La courbe d’étalonnage correspondant à ces solutions filles a été réalisée :
Q6. Justifier que
l’absorbance peut être modélisée par la relation A = k·C et vérifier
que le coefficient k a pour valeur 0,156 L∙mg
−1 à l’aide d’une méthode de votre choix.
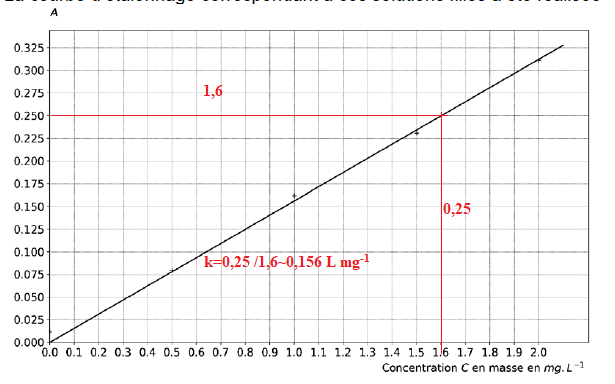
La courbe est une droite passant par l'origine ( fonction linéaire).
A = 0,156 C.
Avant d’analyser l’échantillon d’eau de piscine, il est nécessaire de
le filtrer sur filtre Büchner. Le filtrat est ainsi récupéré.
On récupère après la filtration sur filtre Büchner, V
filtrat = 5,00 mL du filtrat de l’eau de la piscine qui est placé dans une fiole jaugée de 25,0 mL, auquel on ajoute V
réactif =
5,00 mL de réactif spécifique afin d’obtenir le complexe coloré. On
complète avec de l’eau distillée jusqu’au trait de jauge et on agite.
L’absorbance de la solution filtrée et colorée est ensuite mesurée à la
même longueur d’onde que précédemment. L’absorbance mesurée vaut A
eau = 0,075.
Q7. À partir des données et des résultats expérimentaux, donner la qualité de l’eau de piscine étudiée.
C =A / 0,156 = 0,075 /0,156 ~0,48 mg / L.
Cette valeur étant comprise entre 0,2 et 0,5 mg /L, l'eau est de qualité passable.