Partie B – Étude de la phénylalanine méthylée
Formule topologique de la phénylalanine méthylée
Nommer les groupes caractéristiques A et B entourés sur la figure.
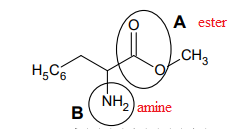
Pour la suite de l’exercice, on note la phénylalanine méthylée R-N̅H
2
.
11. Justifier, à partir de la structure de R-N̅H
2
, son caractère basique au sens de Brønsted.
R-N̅H
2 est susceptible de gagner un proton : c'est une base de Brônsted.
12. En déduire la formule de l’acide conjugué de R-N̅H
2
.
R-NH
3+.
13. Établir l’équation de la réaction de la phénylalanine méthylée avec l’eau.
R-N̅H
2 aq + H
2O(l) = RNH
3+ aq + HO
-aq.
Soit un volume V = 1,00 L d’une solution S de phénylalanine méthylée de concentration en
quantité de matière c = 1,00 × 10
–1 mol∙L
–1
. Le pH de cette solution est égal à 12,9.
14. Calculer le taux d’avancement final
t et conclure sur la force de la base, la phénylalanine
méthylée.
Le candidat est invité à prendre des initiatives et à présenter sa démarche. Toute
démarche pertinente, même non aboutie, sera valorisée.
état
|
R-N̅H2 aq |
+H2O(l) |
RNH3+ aq |
HO-aq |
initial
|
0,100
|
solvant
|
0
|
0
|
final
|
0,10-xf
|
xf
|
xf
|
t = x
f / x
max.
x
max = CV = 0,1 mol.
[HO
-aq] = 10
-14 / 10
-12,9 =0,0794
mol / L.
t ~0,79 < 1.
La phénylalanine
méthylée est une base faible.
Partie C – Stratégie de synthèse
On souhaite créer une liaison entre l’acide aspartique et la phénylalanine méthylée pour
obtenir l’aspartame selon l’équation de réaction donnée en début d’exercice.
15. Identifier en expliquant, parmi les catégories suivantes, celle à laquelle appartient cette
transformation : oxydoréduction, acide-base, addition, élimination, substitution.
La fonction acide carboxylique réagit avec la fonction amine pour former un amide : réaction de substitution.
16. Sur l’étape 1 de la figure ,
faire apparaître les sites donneurs et accepteurs de doublet d’électrons des réactifs
impliqués lors de la synthèse.
17. Représenter, sur l’étape 1 de la figure, les flèches courbes de l’acte élémentaire correspondant à l’obtention de
l’intermédiaire réactionnel.
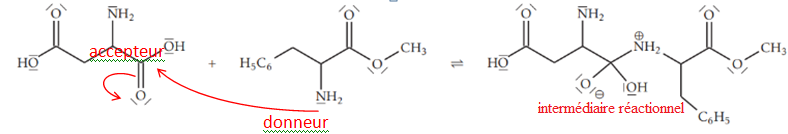 18.
18. Identifier, en justifiant, l’intermédiaire réactionnel de cette synthèse.
L'intermédiaire réactionnel est formé à l'étape 1 puis consommé à l'étape suivante.
19. Justifier que d’autres intermédiaires réactionnels sont susceptibles de se former.
Il y a plusieurs fonctions amine et acide carboxylique : d'autres intermédiaires réactionnels peuvent se former.
20. Proposer une stratégie à adopter pour s’assurer de la formation de l’aspartame
uniquement.
Protéger la fonction acide carboxylique et la fonction amine qui ne doivent pas réagir.
Faire la réaction désirée.
Déprotéger la fonction acide carboxylique et la fonction amine qui avaient été protégé.